题目内容
【题目】常温下,将NaOH固体分别加入浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,lg![]() 随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是( )
随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是( )
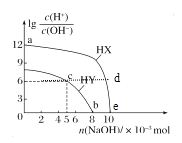
A.由a点到e点水的电离程度先增大后减小
B.d点溶液中存在:c(HX)+c(X-)=0.1mol/L
C.c点溶液中存在:c(Y-)+2c(OH-)=2c(H+)+c(HY)
D.b点溶液中存在:c(HY)+c(Na+)=0.1mol/L
【答案】CD
【解析】
A. a点lg![]() =12,则溶液中c(H+)=0.1mol/L,可知HX为强酸,e点lg
=12,则溶液中c(H+)=0.1mol/L,可知HX为强酸,e点lg![]() =0,则溶液中c(H+)=10-7mol/L完全中和,强酸对水的电离起抑制作用,酸的浓度减小,则水的电离变大,由a点到e点水的电离程度一直增大,A项错误;
=0,则溶液中c(H+)=10-7mol/L完全中和,强酸对水的电离起抑制作用,酸的浓度减小,则水的电离变大,由a点到e点水的电离程度一直增大,A项错误;
B. HX为强酸会完全电离,溶液中不存在HX,B项错误;
C. c点lg![]() =6,则溶液中c(H+)=10-4mol/L,此时消耗的NaOH为0.005mol,则溶液中的溶质为NaY和HY,根据电荷守恒有c(Y-)+c(OH-)=c(H+)+ c(Na+),根据元素守恒有c(Y-)+c(HY)=2c(Na+),联立两个等式可得c(Y-)+2c(OH-)=2c(H+)+c(HY),所以c(Y-)+2c(OH-)=2c(H+)+c(HY),C项正确;
=6,则溶液中c(H+)=10-4mol/L,此时消耗的NaOH为0.005mol,则溶液中的溶质为NaY和HY,根据电荷守恒有c(Y-)+c(OH-)=c(H+)+ c(Na+),根据元素守恒有c(Y-)+c(HY)=2c(Na+),联立两个等式可得c(Y-)+2c(OH-)=2c(H+)+c(HY),所以c(Y-)+2c(OH-)=2c(H+)+c(HY),C项正确;
D. b点lg![]() =0,则溶液中c(H+)=10-7mol/L= c(OH-),根据电荷守恒有c(Y-)+c(OH-)=c(H+)+ c(Na+),即c(Y-) = c(Na+),根据元素守恒有c(Y-)+c(HY)=0.1mol/L,联立两个等式可得c(HY)+c(Na+)=0.1mol/L,所以c(HY)+c(Na+)=0.1mol/L,D项正确;
=0,则溶液中c(H+)=10-7mol/L= c(OH-),根据电荷守恒有c(Y-)+c(OH-)=c(H+)+ c(Na+),即c(Y-) = c(Na+),根据元素守恒有c(Y-)+c(HY)=0.1mol/L,联立两个等式可得c(HY)+c(Na+)=0.1mol/L,所以c(HY)+c(Na+)=0.1mol/L,D项正确;
答案选CD。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】在试管中进行下列实验,现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向硫酸铜水溶液中逐滴加入氨水 | 先产生蓝色沉淀,然后溶解,最后得到深蓝色透明溶液 |
B | 向I2的CCl4溶液中加入浓KI溶液,振荡 | 溶液紫红色变浅 |
C | 向橙色的K2Cr2O7溶液中加入10滴浓硫酸,振荡 | 溶液由橙色变为黄色 |
D | 向饱和硼酸溶液中加入Na2CO3溶液 | 无明显现象 |
A.AB.BC.CD.D