题目内容
【题目】烟气是气体和烟尘的混合物,是污染居民区大气的主要原因,气体中的污染气体主要是 SO2 及氮氧化合物等。
Ⅰ.某实验小组模拟湿式石灰/石灰法空气脱硫,他们主要是使用石灰石(CaCO3)浆液作洗涤剂,对烟气进行洗涤,从而除去烟气中的SO2。
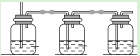
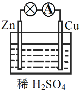
(1)上图是实验小组设计的装置图的一部分,三个装置中均盛放石灰浆液,这样设计的目的是________________。在所得的产物中通入臭氧可得生石膏,写出反应的方程式_________________________。
(2)二氧化硫通入氯化钡溶液中不产生沉淀,通入另一种气体A后可以产生白色沉淀,则下列哪组试剂产生的气体符合A的要求___________。
A.大理石和盐酸 B. 氧化钙和浓氨水 C. 铜和浓硝酸 D. 高锰酸钾和浓盐酸
(3)为了测定烟气中二氧化硫的含量,他们设计了下列方案:先将含二氧化硫的aL烟气用氯水氧化,再用沉淀剂氯化钡获得沉淀,最终获得bg沉淀。在称量沉淀前应对沉淀进行洗涤,如何证明沉淀洗涤干净______________________________________________。烟气中二氧化硫的浓度为_________g/L。
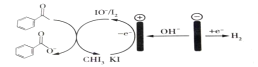
Ⅱ. 某烟气研究组采用尿素H2N(CO)NH2,溶液在50~70℃时进行脱硫脱硝,装置如图所示。
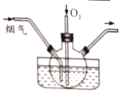
(1)如果不通入氧气,发现只有少量的烟气被吸收,生成对环境友好的物质。 被吸收的气体为___________ ;发生反应的化学方程式为_________________________。
(2) 如果通入烟气和一定量氧气的混合气,氮氧化物的吸收率仍然较低,可能的原因是____________________________。
【答案】充分吸收二氧化硫 CaSO3+O3+2H2O=CaSO4·2H2O+O2 BCD 取最后一次洗涤液于试管中,加入硝酸酸化的硝酸银,若无白色沉淀生成,则洗涤干净 ![]() NO2 6NO2+4H2N(CO)NH2=7N2+4CO2+8H2O 通入氧气少,NO没全部转化为NO2
NO2 6NO2+4H2N(CO)NH2=7N2+4CO2+8H2O 通入氧气少,NO没全部转化为NO2
【解析】
I.(1)采用多装置进行吸收的目的是使二氧化硫充分吸收;二氧化硫与与氢氧化钙反应生成亚硫酸钙,亚硫酸钙具有还原性,臭氧具有氧化性,二者能够发生氧化还原反应生成生石膏,根据氧化还原反应守恒关系配平;
(2)二氧化硫通入氯化钡溶液中不产生沉淀,通入另一种气体A后可以产生白色沉淀,则说明溶液中生成了![]() 或
或![]() ,据此解答;
,据此解答;
(3)沉淀若洗涤干净,则沉淀表面无BaCl2,可通过检验Cl-方法验证;根据反应硫原子守恒和质量守恒计算;
II.(1)生成了对环境友好的物质,根据元素守恒可知该物质为N2、CO2,根据元素守恒解答;根据无氧环境以及氧化还原反应得失电子守恒、原子守恒、元素守恒书写方程式;
(2)氮氧化合物完全被吸收,N元素化合价需升高,氧气中氧元素化合价会降低,根据守恒关系以及实际实验结果分析。
I.(1)采用多装置进行吸收的目的是保证二氧化硫充分吸收;吸收生成的产物为亚硫酸钙,亚硫酸钙具有还原性,臭氧具有氧化性,反应过程中亚硫酸钙被氧化为硫酸钙,臭氧一部分被还原,根据化合价升降守恒、原子守恒可知其反应方程式为:CaSO3+O3+2H2O=CaSO4·2H2O+O2;
(2)A.大理石和盐酸反应生成CO2,通入溶液中不参加反应,不会产生白色沉淀,故A不符合题意;
B. 氧化钙和浓氨水反应生成氨气,氨气为碱性气体,二氧化硫为酸性气体,二者反应会生成亚硫酸铵,亚硫酸铵电离出亚硫酸根离子,亚硫酸根离子能与钡离子反应生成亚硫酸钡沉淀,故B符合题意;
C. 铜和浓硝酸反应生成二氧化氮,二氧化氮溶于水能生成硝酸,硝酸具有氧化性,能够将二氧化硫溶于水生成的亚硫酸氧化为硫酸,硫酸电离出的硫酸根离子能与钡离子反应生成硫酸钡沉淀,故C符合题意;
D. 高锰酸钾和浓盐酸反应生成氯气,氯气具有氧化性,能够将二氧化硫溶于水生成的亚硫酸氧化为硫酸,硫酸电离出的硫酸根离子能与钡离子反应生成硫酸钡沉淀,故D符合题意;
故答案为:BCD;
(3)由上述分析可知,需检验最后一次洗涤液中是否含有Cl-即可判断沉淀是否洗涤干净,具体操作为:取最后一次洗涤液于试管中,加入硝酸酸化的硝酸银,若无白色沉淀生成,则洗涤干净;最终得到的沉淀为BaSO4,![]() ,根据硫原子守恒可知,aL含SO2的烟气中含SO2的质量
,根据硫原子守恒可知,aL含SO2的烟气中含SO2的质量![]() ,烟气中二氧化硫的浓度为
,烟气中二氧化硫的浓度为![]() ;
;
II.(1)无氧环境下,生成了对环境友好的物质,烟气中硫元素对应氧化物均会污染空气,因此该物质为N2、CO2,根据元素守恒可知,被吸收的物质为NO2;H2N(CO)NH2中N元素化合价为-3,反应过程中N元素化合价升高至0价,C、H、O元素化合价均不变化,NO2中N元素化合价为+4价,反应过程中N元素化合价降低至0价,根据氧化还原反应得失电子守恒以及原子守恒、元素守恒可知其反应方程式为:6NO2+4H2N(CO)NH2=7N2+4CO2+8H2O;
(2)在有氧环境下,二氧化氮被吸收生成HNO3,N元素化合价升高,氧气中氧元素化合价会降低,若通入的氧气量不足时,NO2与水反应生成的NO未能完全被氧化,导致氮氧化合物的吸收率较低。

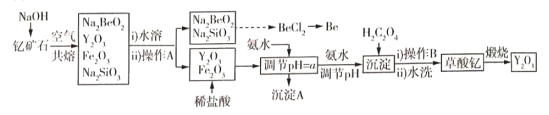
【题目】中国是稀土资源大国,稀土是化学元素周期表中镧系元素和钪、钇共十七种金属元素的总称,被誉为“万能之土”。某小组以钇矿石(Y2FeBe2Si2O10)为主要原料制备氧化钇(Y2O3)和铍的流程(部分条件和产物省略)如图所示:
已知部分信息如下:
①铍、铝的单质及其化合物的化学性质相似;
②稀土元素都是活泼金属,性质相似,常见化合价为+3;
③Fe3+ Y3+形成的氢氧化物沉淀的pH范围如表所示:
离子 | Fe3+ | Y3+ |
开始沉淀的PH | 2.1 | 6.0 |
完全沉淀的PH | 3.1 | 8.3 |
请回答下列问题:
(1)沉淀A的主要成分是______(填化学式);操作A的名称是____________________。
(2)钇矿石与氢氧化钠共熔反应中的氧化产物为__________;写出加入草酸生成沉淀的离子方程式:___________;草酸钇隔绝空气煅烧的方程式______________。
(3)调节pH=a,则a的范围为______________。
(4)已知常温下;K[Y(OH)3]=1.0×10-23。Y3++3H2O=Y(OH)3+3H+平衡常数为K,则pK=-lgK=_____。
(5)叙述由Na2SiO3和Na2BeO3溶液制取BeCl2固体的过程:_______________。