题目内容
【题目】向Fe2(SO4)3溶液中加入KSCN溶液,发生反应:Fe3++SCN-[Fe(SCN)]2+;若加入K4[Fe(CN)6]溶液,两者发生反应会生成Fe4[Fe(CN)6]3沉淀。
(1)基态Fe原子的价电子排布式为_______,Fe原子失去电子变成阳离子时,首先失去的电子所处的轨道的形状为_______
(2)[Fe(SCN)]2+的四种元素中第一电离能最大的是_______ (填元素符号,下同),电负性最大的是_______。
(3)配合物Fe(CO)n可作催化剂,Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n =_______
(4)Fe4[Fe(CN)6]3中铁元素的化合价为_______。
(5)SO42-的立体构型为_______。
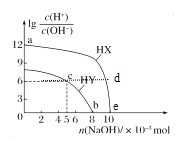
(6)铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg),铁镁合金的化学式为_______;若该晶胞为正方体,棱长为a cm,则镁原子与铁原子间的最短距离为_______cm,晶胞的密度为_______gcm-3。

【答案】3d64s2 球形 N N 5 +2、+3 正四面体 Mg2Fe ![]()
![]()
【解析】
(1)注意审题,书写基态Fe原子的价电子排布式即为3d64s2;原子变成阳离子时,首先失去最外层的电子,即4s能级的电子,这一能级轨道形状即为球形;
(2)Fe、S、C、N四种元素中第一电离能最大的是N元素,电负性最大的也是N元素;
(3)羰基铁配合物中中心原子为Fe,价电子数为8;配体为CO,配位原子为C,有一个孤对电子,所以有![]() ,所以n=5;
,所以n=5;
(4)K4[Fe(CN)6]中的Fe为+2价,所以Fe4[Fe(CN)6]3中铁元素的价态有+2和+3两种;
(5)通过VSEPR理论计算,硫酸根有4个价层电子对,没有孤电子对,所以其空间构型为正四面体;
(6)通过分析晶胞结构,Fe原子处在面心和顶点的位置,Mg原子处在内部,均摊法计算铁镁合金的晶胞中含有铁原子个数为=![]() =4个,镁原子个数为8个,所以化学式即为Mg2Fe;经过分析可知,该铁镁合金晶胞结构与CaF2相同,将晶胞分成相等的8个小正方体,Mg就处在每个小正方体的体心位置,所以Mg和Fe的最近距离即晶胞体对角线的
=4个,镁原子个数为8个,所以化学式即为Mg2Fe;经过分析可知,该铁镁合金晶胞结构与CaF2相同,将晶胞分成相等的8个小正方体,Mg就处在每个小正方体的体心位置,所以Mg和Fe的最近距离即晶胞体对角线的![]() ,即
,即![]() cm;晶胞的密度
cm;晶胞的密度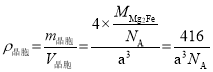 。
。

【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键
【题目】下列实验操作、现象、结论均完全正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 在常温下测定Na2CO3和NaHCO3溶液的pH | Na2CO3溶液pH较大 | 水解能力:Na2CO3大于NaHCO3 |
B | 先向盛有1mL 0.1mol/L的AgNO3溶液的试管中滴加两滴0.1mol/L的NaCl溶液,再向其中滴加0.1mol/L的NaI溶液。 | 滴加NaCl溶液有白色沉淀生成,滴加NaI溶液后有黄色沉淀生成 | AgCl沉淀可转化成AgI沉淀 |
C | 电解饱和CuCl2溶液实验中,用润湿的淀粉—碘化钾试纸靠近阳极 | 润湿的淀粉—碘化钾试纸变蓝 | 阳极产生Cl2 |
D | 饱和FeCl3溶液中加入少量NaCl固体 | 溶液颜色变浅 | 加入NaCl固体后,FeCl3的水解平衡逆向移动 |
A. AB. BC. CD. D