题目内容
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
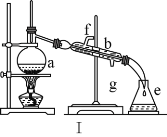
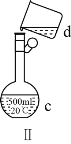
(1)写出下列仪器的名称:a.____,b._____,c.____。
(2)仪器ae中,使用前必须检查是否漏水的有____(填序号)。
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,温度计水银球的位置在____处。冷凝水由(填“f”或“g”,下同)____口通入,_____口流出。
(4)现需配制0.13mol·L1NaOH溶液450mL,装置Ⅱ是某同学转移溶液的示意图。
①根据计算用托盘天平称取NaOH溶液的质量为_____g。为完成此溶液配制实验需要的玻璃仪器有______。
②图Ⅱ中的错误是_____。
③配制时,按以下几个步骤进行:计算、称量、溶解、冷却、转移、定容、摇匀、装瓶。操作中还缺少一个重要步骤是_____。
④取用任意体积的该NaOH溶液时,下列物理量中不随所取体积的多少而变化的是_____(填字母)。
A.溶液中Na的物质的量 B.溶液的浓度
C.NaOH的溶解度 D.溶液的密度
⑤下面操作造成所配NaOH溶液浓度偏高的是_____。
A.暴露在空气中称量NaOH的时间太长
B.将砝码放在左盘上, NaOH放在右盘上进行称量(使用游码)
C.向容量瓶转移液体时,容量瓶内含有蒸馏水
D.溶解后未冷却至室温就转移至容量瓶
E.转移液体时玻璃棒的下端放在容量瓶刻度线以上处
F.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
G.定容时俯视刻度线
【答案】蒸馏烧瓶 冷凝管 500mL容量瓶 c 蒸馏烧瓶支管口 g f 2.6 烧杯、玻璃棒、500 mL 容量瓶、胶头滴管、细口瓶 未用玻璃棒引流 洗涤并转移 BCD DG
【解析】
(1)蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶,酒精灯,根据仪器的结构特点判断;
(2)容量瓶在使用前一定要查漏;
(3)蒸馏时,温度计的水银球要位于蒸馏烧瓶的支管口处;冷凝管下口是进水口,上口是出水口,据此即可解答;
(4)①根据n=cV和m=nM来计算;
②根据配制一定物质的量浓度的溶液的方法和操作来寻找装置中的错误;
③根据配制一定物质的量浓度的溶液的方法,判断操作步骤;
④取用任意体积的该NaOH溶液时,由于溶液具有均一性,则所取溶液的密度、物质的量浓度都不变,而溶质的物质的量、OH﹣的数目与溶液体积有关;
⑤分析操作对溶质物质的量和溶液体积的影响,依据c=![]() 进行误差分析。
进行误差分析。
(1)蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶,酒精灯,a为蒸馏烧瓶,b为冷凝管,C为500mL容量瓶;
(2)容量瓶带有瓶塞,为防止使用过程中漏水,所以在使用前一定要查漏,故答案为:C;
(3)蒸馏试验中,温度计测定的是蒸气温度,温度计应位于蒸馏烧瓶支管口处,冷凝水流向与蒸气流向相反,所以冷凝管下口是进水口,上口是出水口;
(4)①由于无450mL容量瓶,故要选用500ml容量瓶,配制出500mL 0.1mol/L的NaOH溶液,所需的NaOH的物质的量n=cV=0.5L×0.13mol/L=0.065mol,质量m=nM=0.065mol×40g/mol=2.6g;
②配制一定物质的量浓度的溶液是必须用玻璃棒引流,防止液体外溅;
③根据操作过程是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶可知还缺少的操作步骤是洗涤并转移;
④溶液为均一稳定化合物,取用任意体积的该NaOH溶液时,溶液的浓度和密度不变,而体积不同时溶液中含有的钠离子的数目和含有溶质NaOH的物质的量一定不同,所以不随所取体积的多少而变化的是BCD;
⑤A.暴露在空气中称量NaOH的时间太长,氢氧化钠吸收二氧化碳和水,导致称取固体含有溶质物质的量偏小,溶液浓度偏低,故A错误;
B.将砝码放在左盘上,NaOH放在右盘上进行称量(使用游码),导致称取溶质质量偏小,溶质物质的量偏小,溶液浓度偏低,故B错误;
C.向容量瓶转移液体时,容量瓶内含有蒸馏水,对溶质物质的量和溶液体积都不产生影响,溶液浓度无影响,故C错误;
D.溶解后未冷却至室温就转移至容量瓶,冷却后溶液体积偏小,溶液浓度偏高,故D正确;
E.转移液体时玻璃棒的下端放在容量瓶刻度线以上处,导致溶液体积偏大,溶液浓度偏低,故E错误;
F.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出,导致部分溶质损耗,溶质物质的量偏小,溶液浓度偏低,故F错误;
G.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故G正确;
故答案为DG。