��Ŀ����
����Ŀ��ij���жԴ������м�⣬���ָ�����Ҫ��Ⱦ��Ϊ�����������PM2.5(ֱ��С�ڵ���2.5��m������������)������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش��������⣺
��1��PM2.5��ɢ�ڿ������γɵķ�ɢϵ__(����������������������)���塣
��2����PM2.5����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
���ݱ��������жϴ�������Ϊ__(����������������)�ԣ���ʾ����������Ե�c(H��)��c(OH��)=__mol��L-1��
��3��úȼ���ŷŵ���������SO2��NOx���γ����꣬��Ⱦ����������NaClO2��Һ�ڼ��������¿ɶ�������������������Ч���dz��á�������ж������������̵����ӷ���ʽ��
__ClO2-��__NO��__=__Cl-��__NO3-��__
��4��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
�ٽ�úת��Ϊ�������ȼ�ϡ�д����̿��ˮ������Ӧ�Ļ�ѧ����ʽ��__��
��ϴ�Ӻ�SO2���������������ʿ���ϴ�Ӽ�����__(����ĸ)��
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
��5������β����NOx��CO�����ɼ�ת����
�����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��д������������NO�Ļ�ѧ����ʽ��__��
������ȼ�Ͳ���ȫȼ��ʱ����CO��Ŀǰ��������β��ϵͳ��װ�ô�ת�����ɼ���CO��NO����Ⱦ���仯ѧ��Ӧ����ʽΪ__��
���𰸡������� �� 10-4 3 4 4OH- 3 4 2H2O C��H2O(g)![]() CO��H2 ab N2+O2
CO��H2 ab N2+O2![]() 2NO 2CO+2NO
2NO 2CO+2NO![]() 2CO2+N2
2CO2+N2
��������
��1������ķ�ɢϵ�з�ɢ�ʵ�ֱ����1��100nm��
��2���۲�����з������к���![]() ��
��![]() ˮ�������ԣ�PM2.5��Ϊ���ԣ�
ˮ�������ԣ�PM2.5��Ϊ���ԣ�
��3����Ӧ��NԪ�ػ��ϼ���+2�۵�NO����Ϊ![]() ��+5�ۣ�������3�ۣ�ClԪ����
��+5�ۣ�������3�ۣ�ClԪ����![]() ��+3�۽���Ϊ1�ۣ�������4�ۣ����ϼ�������С������Ϊ12����
��+3�۽���Ϊ1�ۣ�������4�ۣ����ϼ�������С������Ϊ12����![]() ϵ��Ϊ3����NOϵ��Ϊ4�����õ���غ㼰Ԫ���غ���ƽ���ʵ�ϵ����
ϵ��Ϊ3����NOϵ��Ϊ4�����õ���غ㼰Ԫ���غ���ƽ���ʵ�ϵ����
��4����̼��ˮ������Ӧ����һ����̼���������ڶ�������Ϊ������������ն���������Լ��Ͷ�����������Ӧ��
��5�������������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ������������NO�ǿ����е����������ŵ�����һ����������������β��ϵͳ��װ�ô�ת�����ɼ���CO��NO����Ⱦ��һ����̼��һ�����������������ɵ����Ͷ�����̼��
��1������ķ�ɢϵ�з�ɢ�ʵ�ֱ����1��100nm��PM2.5��ָ������ֱ���ӽ���2.5��106m�Ŀ����ֱ������100nm����ϸ�������ɢ�ڿ������γɵķ�ɢϵ���ǽ��壬
�ʴ�Ϊ�������ڣ�
��2���۲�����з���![]() ˮ�������ԣ�PM2.5�������Ϊ���ԣ�������pHֵ������Һ�е���غ����õ���
ˮ�������ԣ�PM2.5�������Ϊ���ԣ�������pHֵ������Һ�е���غ����õ���![]() ����������ֵ��������ʽ�ӿɵ�c(H+)=1.0��104mol/L��������Ũ��Ϊ104mol/L��
����������ֵ��������ʽ�ӿɵ�c(H+)=1.0��104mol/L��������Ũ��Ϊ104mol/L��
�ʴ�Ϊ���104��
��3����Ӧ��NԪ�ػ��ϼ���+2�۵�NO����Ϊ![]() ��+5�ۣ�������3�ۣ�ClԪ����
��+5�ۣ�������3�ۣ�ClԪ����![]() ��+3�۽���Ϊ1�ۣ�������4�ۣ����ϼ�������С������Ϊ12����
��+3�۽���Ϊ1�ۣ�������4�ۣ����ϼ�������С������Ϊ12����![]() ϵ��Ϊ3����NOϵ��Ϊ4������ݵ���غ㡢Ԫ���غ㼰��Ӧ�ڼ��������½��У�����ƽ�õķ���ʽΪ��
ϵ��Ϊ3����NOϵ��Ϊ4������ݵ���غ㡢Ԫ���غ㼰��Ӧ�ڼ��������½��У�����ƽ�õķ���ʽΪ��![]() ��
��
�ʴ�Ϊ��3��4��4OH��3��4��2H2O��
��4���ٽ�̿��ˮ������Ӧ����ˮú���Ļ�ѧ����ʽΪ��C��H2O(g)![]() CO��H2��
CO��H2��
�ʴ�Ϊ��C��H2O(g)![]() CO��H2��
CO��H2��
��a������������������������Ծ��������������ͨ�ԣ��ܹ���Ӧ��SO2+Ca(OH)2=CaSO3��+H2O����a��ȷ��
b����������ˮ��Һ�������ᣬ����Ҳ�ܹ���̼���Ʒ�Ӧ��SO2+Na2CO3=Na2SO3+CO2�������Կ�����̼������Һ��ϴ�Ӽ�����b��ȷ��
c�������������Ȼ�����Һ����Ӧ����c����
d��SO2��������������Һ�е��ܽ�Ⱥ�С�����Բ�����������������Һ��ϴ��Һ����d����
�ʴ�Ϊ��ab��
��5���٣�����������NO�ǿ����е����������ŵ�����һ����������Ӧ�Ļ�ѧ����ʽΪ��N2+O2![]() 2NO��
2NO��
�ʴ�Ϊ��N2+O2![]() 2NO��
2NO��
�ڣ�������β��ϵͳ��װ�ô�ת�����ɼ���CO��NO����Ⱦ��һ����̼��һ�����������������ɵ����Ͷ�����̼����Ӧ�Ļ�ѧ����ʽ��2CO+2NO![]() 2CO2+N2��
2CO2+N2��
�ʴ�Ϊ��2CO+2NO![]() 2CO2+N2��
2CO2+N2��

����Ŀ��Q��W��X��Y��Z���ֶ�����Ԫ�������ڱ��е����λ������ͼ��ʾ������W�ĵ�����һ����Ҫ�뵼����ϡ�
|
|
| Y |
|
Q | W | X |
| Z |
�밴Ҫ��ش��������⣺
(1)Y��ԭ�ӽṹʾ��ͼΪ________����һ��˵��Z�ķǽ����Ա�X�ķǽ�����ǿ����ʵ��________��
(2)W��X��Y��ԭ�Ӱ뾶�ɴ�С����![]() ��Ԫ�ط���
��Ԫ�ط���![]() ________��W��Z�γɵĻ��������ʽΪ________��
________��W��Z�γɵĻ��������ʽΪ________��
(3)��Z�ĵ���ͨ�뵽�������ʵ���FeBr2��Һ�г�ַ�Ӧ�����ӷ���ʽΪ________��
(4)��֪�� 2Na(s)+![]() Y2(g)=Na2Y(s)H=-414kJ/mol��2Na(s)+Y2(g)=Na2Y2(s)H=-511kJ/mol����Na2Y(s)ת��ΪNa2Y2(s)�ķ�Ӧһ�����������Է����е�������________����0.2mol Na2Y2���뵽100mL1mol/L��QZ3�У���ַ�Ӧ�Ļ�ѧ����ʽΪ________��
Y2(g)=Na2Y(s)H=-414kJ/mol��2Na(s)+Y2(g)=Na2Y2(s)H=-511kJ/mol����Na2Y(s)ת��ΪNa2Y2(s)�ķ�Ӧһ�����������Է����е�������________����0.2mol Na2Y2���뵽100mL1mol/L��QZ3�У���ַ�Ӧ�Ļ�ѧ����ʽΪ________��
(5)R��Wͬ���ڣ���֪����T��ʱKsp[R(OH)2]��ֵΪ4.0��10-12����R(OH)2������Һ��c(OH-)=________mol/L��
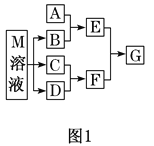
����Ŀ��ij���Է�Һ����H+��Fe3+��Ni2+��NO3����F-��Cr2O72-�ȡ���ͼ�Ǹ÷�Һ���ۺ����ù������̣������裺 F����������ӵ���Ϸ�Ӧ��Ӱ��������Ӧ�ͼ��㣩
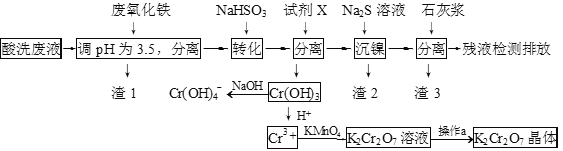
��֪���������ӿ�ʼ�����ͳ�����ȫʱ��pH��
Fe3+ | Ni2+ | Cr3+ | |
��ʼ���� | 1.5 | 6.7 | 4.0 |
������ȫ | 3.4 | 9.5 | 6.9 |
Ni2+��������ˮ�ķ�ӦΪ��Ni2+��6NH3 ![]() [Ni(NH3)6]2+��[Ni(NH3)6]2+Ϊ�ѵ����������ӣ�
[Ni(NH3)6]2+��[Ni(NH3)6]2+Ϊ�ѵ����������ӣ�
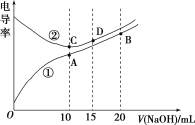
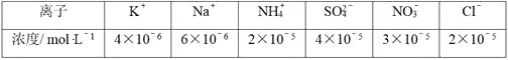
��1������1����Ҫ�ɷ�Ϊ��____________��
��2���Լ�X������������ˮ���������ǣ�____________ ��������ţ�
A��Ni(OH)2 B��Cr2O3 C��Fe2O3 D��NaOH
��3�����Լ�X��������ˮ���������������ӷ���ʽΪ��____________��
��4������⣬���IJ�Һ��c(Ca2+)��1.0��10��5 molL-1�����Һ��F��Ũ��____________���� �����������������������ŷű�[��֪Ksp(CaF2)=4��10-11�������ŷű�Ҫ�������Ũ��С��10 mgL��1]��
��5����(Ni)���仯����㷺Ӧ����������ء���ƺʹ���������
��ij���ط�ӦΪNiO2��Fe��2H2O![]() Fe(OH)2��Ni(OH)2,�ŵ�ʱ�����·��ת��0.6mol��������������____g��
Fe(OH)2��Ni(OH)2,�ŵ�ʱ�����·��ת��0.6mol��������������____g��
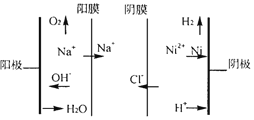
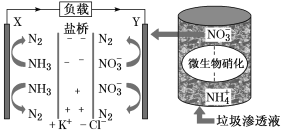
��ͼΪ˫Ĥ���ҵ�ⷨ����������ˮ���ս�������ԭ��ʾ��ͼ�������ĵ缫��ӦʽΪ____���������У���Ҫ������ҺpHֵΪ4���ң�ԭ����_______��