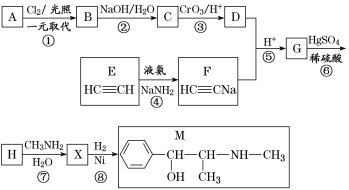
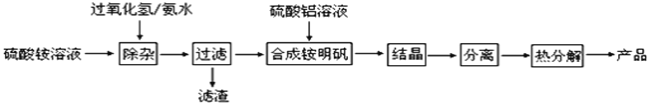
题目内容
【题目】下列说法正确的是( )
A.常温下,1mol·L-1的CH3COOH溶液与1mol·L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.在含有酚酞的0.1mol/L氨水中加入少量的NH4Cl晶体,溶液颜色变浅
C.氢硫酸的电离方程式为:H2S![]() 2H++S2﹣
2H++S2﹣
D.0.1mol/LNa2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
【答案】B
【解析】
A.1mol·L-1的CH3COOH溶液与1mol·L-1的NaOH溶液等体积混合恰好完全反应生成醋酸钠,由于CH3COO-水解,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+),A选项错误;
B.氨水中存在电离平衡NH3·H2O![]() NH4++OH-,在含有酚酞的0.1mol/L氨水中加入少量的NH4Cl晶体,会抑制一水合氨的电离,溶液的碱性降低,故颜色会变浅,B选项正确;
NH4++OH-,在含有酚酞的0.1mol/L氨水中加入少量的NH4Cl晶体,会抑制一水合氨的电离,溶液的碱性降低,故颜色会变浅,B选项正确;
C.硫化氢是弱酸,电离时分步电离,电离方程式为:H2S ![]() H++HS-,HS-
H++HS-,HS- ![]() H++S2-,C选项错误;
H++S2-,C选项错误;
D.0.1mol/LNa2CO3溶液中存在着物料守恒:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),D选项错误;
答案选B。

练习册系列答案
相关题目