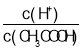题目内容
【题目】电解质溶液的电导率越大,导电能力越强。用0.1mol·L-1的NaOH溶液分别滴定体积均为10.00mL、浓度均为0.1mol·L-1的盐酸和CH3COOH溶液,利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
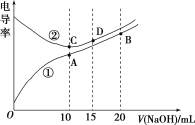
A.曲线①代表滴定CH3COOH溶液的曲线
B.A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol·L-1
C.在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C
D.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
【答案】C
【解析】
A.浓度相同的醋酸和盐酸,醋酸电离程度小于盐酸,则c(H+)盐酸大于醋酸,c(H+)越大溶液导电性越强,所以相同浓度的盐酸和醋酸,盐酸导电性大于醋酸,根据图知导电性①<②,所以①代表滴定CH3COOH溶液的曲线,选项A正确;
B.A点醋酸和NaOH恰好完全反应生成醋酸钠,溶液中存在电荷守恒c(CH3COO-)+c(OH-)- c(H+)=c(Na+),二者等体积混合时c(Na+)是原来的一半,所以A点溶液中:c(CH3COO-)+ c(OH-)- c(H+)=0.05 mol.L-1,选项B正确;
C.相同温度下,A点溶液中溶质为醋酸钠、B点溶液中溶质为等物质的量浓度的醋酸和醋酸钠、C点溶液中溶质为NaCl,酸或碱抑制水电离,含有弱离子的盐促进水电离,所以B点抑制水电离、A点促进水电离、C点不促进也不抑制水电离,则在相同温度下,A、B、C三点溶液中水电离的c(H+):B<C<A,选项C错误;
D.D点溶液中溶质为NaCl和NaOH,且c(NaCl)=2c(NaOH),溶液中存在物料守恒和电荷守恒,根据电荷守恒得c(Cl-)+ c(OH-)= c(H+)+ c(Na+),根据物料守恒得3c(Cl-)=2 c(Na+),所以得c(Cl-)=2 c(OH-)-2 c(H+),选项D正确;
答案选C。