题目内容
20.在298K、101kPa时,充分燃烧一定量的丁烷,放出热量Q kJ(Q>0),经测定完全吸收生成的二氧化碳需要消耗5mol•L-1的KOH溶液100mL,恰好生成正盐.则此条件下,下列热化学方程式正确的是( )| A. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-16Q kJ•mol-1 | |
| B. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-8Q kJ•mol-1 | |
| C. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-Q kJ•mol-1 | |
| D. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-Q kJ•mol-1 |
分析 充分燃烧一定量的丁烷发生的反应为:2C4H10+13O2$\frac{\underline{\;点燃\;}}{\;}$8CO2+10H2O,CO2恰好与KOH溶液完全反应生成正盐为K2CO3,2KOH+CO2═H2O+K2CO3,根据n=c×V计算KOH的物质的量,根据钾元素守恒计算n(K2CO3),根据碳元素守恒有n(CO2)=n(K2CO3),据此计算判断.
解答 解:KOH的物质的量为n(KOH)=c×V=0.1L×5mol/L=0.5mol,
2KOH+CO2═H2O+K2CO3,
根据钾离子守恒,故n(K2CO3)=0.25mol,
根据碳元素守恒由n(CO2)=n(K2CO3)=0.25mol,
2C4H10+13O2$\frac{\underline{\;点燃\;}}{\;}$8CO2+10H2O
根据碳元素守恒可知,丁烷的物质的量为n(C4H10)=0.25mol×$\frac{1}{4}$=$\frac{1}{16}$mol,
即$\frac{1}{16}$ mol丁烷放出的热量大小为QkJ,
故1mol丁烷完全燃烧放出的热量为16QkJ,
则此条件下反应热化学方程式为C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-16Q kJ•mol-1,
故选A.
点评 本题考查反应热的计算,根据氢氧化钾确定丁烷的物质的量是解答该题的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.Co是恶性肿瘤的“克星”,它的射线能破坏癌细胞的快速繁殖,钴一60是非常广泛的放射源,在医疗上常用于肺癌和肿瘤放射治疗.下列有关${\;}_{2}^{6}$${\;}_{7}^{0}$Co的说法中正确的是( )
| A. | 质子数为60 | B. | 原子序数为27 | C. | 中子数为27 | D. | 核外电子数为33 |
11.下列说法正确的是( )
| A. | 淀粉和纤维素在人体内均可水解生成葡萄糖 | |
| B. | 溴乙烷在浓硫酸、加热的条件下发生消去反应生成乙烯 | |
| C. | 乙烯、苯分子中都含有碳碳双键,都能发生加成反应 | |
| D. | 饱和Na2SO4溶液和浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 |
8.A、B、C、D为四种短周期元素,已知A、C同主族,B、C、D同周期,:A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层.下列叙述中正确的是( )
| A. | 原子序数:B>D>A>C | B. | 单质熔点:D>B,A>C | ||
| C. | 原子半径:D>B>C>A | D. | 简单离子半径:D>B>C>A |
15.下列叙述不正确的是( )
| A. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次降低 | |
| B. | 制备纯净的氯乙烷可用等物质的量乙烷和氯气在光照条件下反应 | |
| C. | 等物质的量的乙烷、乙烯和苯分别在氧气中充分燃烧,消耗氧气最多的是苯 | |
| D. | 用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,当反应达到平衡时,18O存在于水、乙醇以及乙酸乙酯 |
12.阿伏加德罗常数的值为NA,下列叙述中错误的是( )
①3.2g O2和O3的混合气中含有的氧原子数目为0.2NA
②含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA
④标准状况下,22.4LC6H6(苯)的分子数目为NA
⑤1L 0.1mol/L的 Al2(SO4)3溶液中,Al3+的数目为0.2NA.
①3.2g O2和O3的混合气中含有的氧原子数目为0.2NA
②含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA
④标准状况下,22.4LC6H6(苯)的分子数目为NA
⑤1L 0.1mol/L的 Al2(SO4)3溶液中,Al3+的数目为0.2NA.
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ②③④⑤ | D. | ③④⑤ |
9.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:
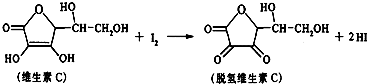
下列说法正确的是( )

下列说法正确的是( )
| A. | 上述反应为取代反应 | B. | 滴定时应剧烈振荡锥形瓶 | ||
| C. | 滴定时可用淀粉溶液作指示剂 | D. | 维生素C的分子式为C6H6O6 |
10.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 标准状况下22.4 L的CCl4中含有NA个分子 | |
| B. | 1 mol Cl2溶于足量水中一定转移NA个电子 | |
| C. | 18 g 18O2和18O3中一共含有NA个18O原子 | |
| D. | 1 mol•L-1的NaOH溶液中共含有NA个Na+ |
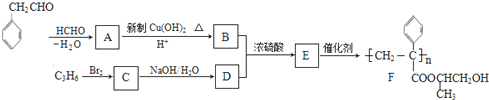
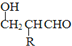 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$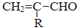
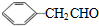 的相对分子质量大2,则符合下列条件的G的同分异构体有3种.
的相对分子质量大2,则符合下列条件的G的同分异构体有3种.