题目内容
8.A、B、C、D为四种短周期元素,已知A、C同主族,B、C、D同周期,:A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层.下列叙述中正确的是( )| A. | 原子序数:B>D>A>C | B. | 单质熔点:D>B,A>C | ||
| C. | 原子半径:D>B>C>A | D. | 简单离子半径:D>B>C>A |
分析 A、B、C、D是四种短周期元素,A、C同主族,A的气态氢化物比C的气态氢化物稳定,故A、C为非金属,原子序数C>A,A处于第二周期,C处于第三周期;B、C、D同周期,均处于第三周期,B的阳离子比C的阴离子少一个电子层,则B为金属元素、C非金属元素,B的阳离子比D的阳离子氧化性强,则金属性B<D,同周期自左而右金属性减弱、非金属性增强,故原子序数D<B<C,据此解答.
解答 解:A、B、C、D是4种短周期元素,A、C同主族,A的气态氢化物比C的气态氢化物稳定,故A、C为非金属,原子序数C>A,A处于第二周期,C处于第三周期;B、C、D同周期,均处于第三周期,B的阳离子比C的阴离子少一个电子层,则B为金属元素、C非金属元素,B的阳离子比D的阳离子氧化性强,则金属性B<D,同周期自左而右金属性减弱、非金属性增强,故原子序数D<B<C.
A.由上述分析可知,原子序数 C>B>D>A,故A错误;
B.B与D为金属晶体,而B的阳离子电荷较大、离子半径较小,金属键更强,故熔点B>D;A、C单质熔点:可能A<C,如B为氧气、C为硫,可能为A>C,如A为金刚石、B为晶体硅,故B错误;
C.同周期从左到右元素原子半径逐渐减小,所以原子半径:D>B>C,同主族从上到下原子半径逐渐增大,所以原子半径C>A,故原子半径:D>B>C>A,故C正确;
D.A、B、D离子的核外电子排布相同,C离子的核外电子排布比A、B、C的离子多一个电子层,电子层数越多,离子半径越大,故C阴离子半径最大,核外电子排布相同时,核电荷数越大,离子的半径越小,原子序数:B>D>A,所以离子半径:C>A>D>B,故D错误;
故选C.
点评 本题考查位置结构性质关系应用,关键是确定元素的相对位置关系,注意对元素周期律理解掌握,注意B选项中晶体熔沸点的比较,难度中等.

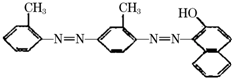 据中央电视台每周质量报告报道.北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.“苏丹红Ⅳ号”的结构简式如图.下列关于“苏丹红Ⅳ号”说法正确的是( )
据中央电视台每周质量报告报道.北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.“苏丹红Ⅳ号”的结构简式如图.下列关于“苏丹红Ⅳ号”说法正确的是( )| A. | 属于芳香烃 | B. | 属于苯的同系物 | C. | 属于氨基酸 | D. | 能发生加成反应 |
| A. | SO32-、K+、NH4+ | B. | K+、I-、Cl- | C. | Na+、NH4+、S2- | D. | Na+、ClO-、NO3- |
| A. | 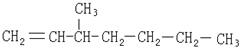 | B. | 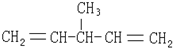 | ||
| C. |  | D. | 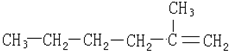 |
| A. | 不同金属的冶炼方法选择的原则主要是依据金属离子得电子的能力 | |
| B. | 金属的冶炼都是置换反应 | |
| C. | 应该大力开发金属矿物资源以满足人类生产生活的需要 | |
| D. | 工业上从海水中提取镁:海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{电解}{→}$Mg |
| A. | O3是氧的一种同位素,其中含有共价键,属于共价化合物 | |
| B. | NaOH、HNO3中都含有离子键和共价键 | |
| C. | 235U、238U是两种不同核素,属于同一种元素 | |
| D. | 已知石墨合成金刚石是吸热反应,金刚石比石墨稳定 |
| A. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-16Q kJ•mol-1 | |
| B. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-8Q kJ•mol-1 | |
| C. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-Q kJ•mol-1 | |
| D. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-Q kJ•mol-1 |
| A. | 2NH3+3Cl2═N2+6HCl | B. | 2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$ N2+3Cu+3H2O | ||
| C. | Cl2+2NaOH═NaCl+NaClO+H2O | D. | KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O |