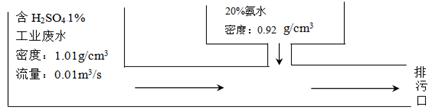
题目内容
(共16分) 硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
① Na2SO4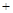 4C
4C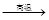 Na2S
Na2S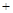 4CO↑
4CO↑
② Na2SO4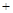 4CO
4CO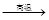 Na2S
Na2S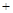 4CO2
4CO2
(1)、现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)、若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量n的范围是
<n< ;
(3)、若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y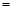 ;
;
(4)、Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量硫酸,充分反应后,过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各成分的物质的量分别为 。
(请写出计算过程)
① Na2SO4
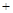 4C
4C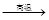 Na2S
Na2S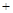 4CO↑
4CO↑② Na2SO4
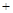 4CO
4CO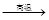 Na2S
Na2S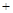 4CO2
4CO2(1)、现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)、若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量n的范围是
<n< ;
(3)、若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y
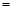 ;
;(4)、Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量硫酸,充分反应后,过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各成分的物质的量分别为 。
(请写出计算过程)
(1).15.78 (2分) (2).2 mol ~ 4 mol。(4分) (3).y =(x+2)/4(1+x) (4分) (4).n(Na2S)="0.25" mol n(Na2SO3)="0.10" mol n(Na2SO4)="0.05" mol
(1). 7.80 gNa2S是0.1mol,所以根据钠原子守恒可知,需要Na2SO4是0.1mol×142g/mol÷0.9=15.78g。
(2).由反应①和②可得反应③:Na2SO4+ 2C Na2S + 2CO2↑根据反应①和反应③,由极值法得:消耗的碳单质的物质的量范围n的范围是:2 mol ~ 4 mol。
Na2S + 2CO2↑根据反应①和反应③,由极值法得:消耗的碳单质的物质的量范围n的范围是:2 mol ~ 4 mol。
(3).设CO2的物质的量是amol,则CO是axmol。根据电子的得失守恒可知,4a+2ax=8y。又因为a+ax=1,所以y =(x+2)/4(1+x) 。
(4).硫化氢的物质的量是0.05mol,单质硫是0.3mol
因为2Na2S+ Na2SO3+3 H2SO4→3 Na2SO4+ 3S↓+3H2O
Na2S+ H2SO4→Na2SO4+H2S
所以根据以上两个反应结合题中条件可求得: 39.20 g样品中有
Na2SO3: 0.10 mol Na2S: 0.250mol
再应用质量守恒得:Na2SO4:0.05 mol
(2).由反应①和②可得反应③:Na2SO4+ 2C
 Na2S + 2CO2↑根据反应①和反应③,由极值法得:消耗的碳单质的物质的量范围n的范围是:2 mol ~ 4 mol。
Na2S + 2CO2↑根据反应①和反应③,由极值法得:消耗的碳单质的物质的量范围n的范围是:2 mol ~ 4 mol。(3).设CO2的物质的量是amol,则CO是axmol。根据电子的得失守恒可知,4a+2ax=8y。又因为a+ax=1,所以y =(x+2)/4(1+x) 。
(4).硫化氢的物质的量是0.05mol,单质硫是0.3mol
因为2Na2S+ Na2SO3+3 H2SO4→3 Na2SO4+ 3S↓+3H2O
Na2S+ H2SO4→Na2SO4+H2S
所以根据以上两个反应结合题中条件可求得: 39.20 g样品中有
Na2SO3: 0.10 mol Na2S: 0.250mol
再应用质量守恒得:Na2SO4:0.05 mol

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目