题目内容
把300mL2.0 mol/L CuSO4溶液和l00 mL l.0 mol/LH2SO4溶液混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。计算
(1)混合溶液中CuSO4的物质的量浓度。
(2)混合溶液中Cu 2+、H+、SO42-的物质的量浓度。
(1)混合溶液中CuSO4的物质的量浓度。
(2)混合溶液中Cu 2+、H+、SO42-的物质的量浓度。
(1)1.5mol/L;(2)1.5mol/L、0.5mol/L、1.75mol/L
考查根据化学方程式进行的有关计算。
(1)混合前硫酸铜的物质的量是0.3L×2.0mol/L=0.6mol
所以混合后CuSO4的物质的量浓度是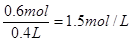
(2)混合前硫酸的物质的量是0.1L×1.0mol/L=0.1mol
所以混合后硫酸的物质的量浓度是
所以混合溶液中Cu 2+、H+、SO42-的物质的量浓度分别是1.5mol/L、0.5mol/L、1.75mol/L
(1)混合前硫酸铜的物质的量是0.3L×2.0mol/L=0.6mol
所以混合后CuSO4的物质的量浓度是
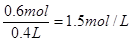
(2)混合前硫酸的物质的量是0.1L×1.0mol/L=0.1mol
所以混合后硫酸的物质的量浓度是

所以混合溶液中Cu 2+、H+、SO42-的物质的量浓度分别是1.5mol/L、0.5mol/L、1.75mol/L

练习册系列答案
相关题目
 4C
4C Na2S
Na2S ;
;