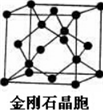
题目内容
4. 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.(1)基态Ni原子的价电子排布式为3d84s2.
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体(原子数相同、电子总数相同)的一种分子和一种离子的化学式N2、CN-.
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.如①CH2=CH2、②HC≡CH、③
 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.(4)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO>FeO(填“<”或“>”);
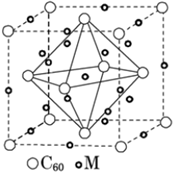
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示.该合金的化学式为LaNi5或Ni5La.
分析 (1)Ni是28号元素,根据能量最低原则、泡利不相容原理和洪特规则,写出其核外电子排布式为:1s22s22p43s23p43d84s2,据此判断其外围电子排布式;
(2)根据等电子体中原子数相同、价电子数相同分析;
(3)根据碳原子含有的σ键和孤电子对判断碳原子采取的杂化方式; 根据价层电子对互斥理论判断甲醛的空间构型;
(4)离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比,与离子所带电荷成正比;
(5)该晶胞中La原子个数=8×$\frac{1}{8}$=1,Ni原子个数=1+8×$\frac{1}{2}$=5,据此确定化学式.
解答 解:(1)Ni是28号元素,其核外电子排布式为:1s22s22p43s23p43d84s2,价电子数为10,价电子排布式为3d84s2,故答案为:3d84s2;
(2)CO含有2个原子14个电子,所以CO互为等电子体的一种分子和一种离子的化学式为:N2、CN-(或O22+、C22-、NO+),故答案为:N2;CN-;
(3)①CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
②HC≡CH中每个碳原子含有2个σ键,不含孤电子对,所以采取sp杂化,故错误;
③ 中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
④HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
HCHO中碳原子含有3个σ键,不含孤电子对,所以其空间构型是平面三角形;
故答案为:①③④; 平面三角;
(4)离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比,与离子所带电荷成正比,Ni2+和Fe2+的半径分别为69pm和78pm,则Ni2+半径小于Fe2+的半径,两种晶体中阴阳离子所带电荷都相同,所以晶格能NiO>FeO,所以熔点NiO>FeO,故答案为:>;
(5)该晶胞中La原子个数=8×$\frac{1}{8}$=1,Ni原子个数=1+8×$\frac{1}{2}$=5该晶胞中La、Ni原子个数之比为1:5,所以化学式为LaNi5或Ni5La,故答案为:LaNi5或Ni5La.
点评 本题考查了价电子的排布式、原子杂化方式判断、晶胞计算及晶体熔沸点大小比较等知识点,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 非金属氧化物肯定是酸性氧化物 | |
| B. | 碱性氧化物肯定是金属氧化物 | |
| C. | 金属氧化物都是碱性氧化物 | |
| D. | 不能跟酸反应的氧化物一定能跟碱反应 |

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
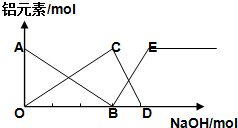
| A. | AB线表示Al3+的物质的量的变化 | B. | OC表示AlO2-的物质的量的变化 | ||
| C. | CD线表示Al(OH)3的物质的量的变化 | D. | BE线表示AlO2-的物质的量的变化 |
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O、N、C.
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x 的值为4.