题目内容
19.已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O、N、C.
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x 的值为4.
分析 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,X原子的L层上s电子数等于p电子数,则X为C元素;
Y原子核外的L层有3个未成对电子,则Y为N元素;
Z在元素周期表的各元素中电负性仅小于氟,则Z为O元素;
Q单质常温、常压下是气体,原子的M层上有1个未成对的p电子,则Q为Cl元素;
R核电荷数是Y与Q的核电荷数之和,其核电荷数是24,为Cr元素;
E原子序数比R大3,则E为Co元素;
(1)原子核外有几个电子就有几种不同运动状态的电子,N原子核外有1s、2s、2p能级;
(2)同一周期元素,元素的电负性随着原子序数增大而增大;
(3)氢化物的熔沸点与其相对分子质量成正比,但含有氢键的氢化物熔沸点较高;
(4)Cr的最高化合价为+6,R的一种配合物的化学式为RCl3•6H2O,0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀,说明该配合物的氯离子个数是2,另外1个氯原子为內界;
(5)元素Co能形成八面体构型的配合物离子[Co(NH3)xCl2]+,一个氯离子带一个单位负电荷,根据配合物离子电荷确定中心离子电荷,配位体为氨气、氯离子.
解答 解:X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,X原子的L层上s电子数等于p电子数,则X为C元素;
Y原子核外的L层有3个未成对电子,则Y为N元素;
Z在元素周期表的各元素中电负性仅小于氟,则Z为O元素;
Q单质常温、常压下是气体,原子的M层上有1个未成对的p电子,则Q为Cl元素;
R核电荷数是Y与Q的核电荷数之和,其核电荷数是24,为Cr元素;
E原子序数比R大3,则E为Co元素;
(1)原子核外有几个电子就有几种不同运动状态的电子,所以N原子核外电子有7种运动状态,N原子核外有1s、2s、2p能级,有3个能级,故答案为:7;3;
(2)同一周期元素,元素的电负性随着原子序数增大而增大,所以C、N、O元素元素电负性大小顺序是O、N、C,故答案为:O、N、C;
(3)氢化物的熔沸点与其相对分子质量成正比,但含有氢键的氢化物熔沸点较高,氯化氢和甲烷中都不含氢键且氯化氢相对分子质量大于甲烷,水中含有氢键,所以这三种元素氢化物熔沸点高低顺序是H2O>HCl>CH4,故答案为:H2O>HCl>CH4;
(4)R为Cr元素,价电子排布为3d54s1,最高正化合价为+6,0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀,氯化铬(CrCl3•6H2O)和氯化银的物质的量之比是1:2,根据氯离子守恒知,则CrCl3•6H2O化学式中含有2个氯离子为外界离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3•6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2•H2O,
故答案为:+6;B;
(5)元素E能形成八面体构型的配合物离子[Co(NH3)xCl2]+,则配离子中Co元素表现+3价,故则中心离子为Co3+,配体为NH3和Cl-,钴离子配位数为6,x的值为4,
故答案为:Co3+;NH3和Cl-;4.
点评 本题考查结构性质位置关系应用,涉及核外电子排布、电负性、配合物、元素化合物性质等,难度中等,明确元素种类是关键,(5)中注意配合物中外界离子与配体性质区别,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 原子半径大小顺序:r(Z)>r(W)>r(X)>r(Y) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应水化物的酸性比W的最高价氧化物对应水化物的酸性强 | |
| D. | Y的简单氢化物的热稳定性比W的强 |
| A. | v(N2)=1.5 mol•(L•min)-1 | B. | v(NH3)=1.8 mol•(L•min)-1 | ||
| C. | v(H2O)=2.67 mol•(L•min)-1 | D. | v(O2)=1.5 mol•(L•min)-1 |
| A. | 硅酸盐材料的应用历史非常悠久,其中玻璃是人类最早应用的 | |
| B. | 水泥是一种重要的建筑材料,制备水泥和玻璃都需要用到石英 | |
| C. | 普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅 | |
| D. | 玻璃钢和钢都属于复合材料 |
| A. | 已知大多数含氧酸可用通式XOm(OH)n来表示,H2SeO3、HMnO4、H3BO3、H3PO4 四种酸中酸性最强的是H2SeO3 | |
| B. | HF的沸点比H2O低是因水中氢键的键能比氟化氢中氢键能大 | |
| C. | 向加入过量氨水的硫酸铜溶液中加入乙醇,将析出深蓝色晶体来,是因为乙醇分子极性比水小 | |
| D. | H2CO3分子中的非羟基氧的个数为1,然而其酸性较弱,原因是溶于水的二氧化碳分子只有极少数与水结合成碳酸 |
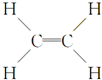 ;
; 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.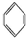 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.