题目内容
12.如图表示向AlCl3溶液滴加NaOH溶液过程中铝元素存在的微粒关系曲线不正确的是( )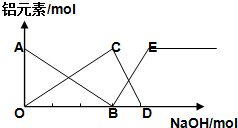
| A. | AB线表示Al3+的物质的量的变化 | B. | OC表示AlO2-的物质的量的变化 | ||
| C. | CD线表示Al(OH)3的物质的量的变化 | D. | BE线表示AlO2-的物质的量的变化 |
分析 向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,据此结合选项解答.
解答 解:向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O,沉淀完全溶解消耗1molOH-,生成1molAlO2-,前后两部分消耗的OH-为3:1,
A.由上述分析可知,首先发生反应Al3++3OH-=Al(OH)3↓,溶液中铝离子物质的量减少AB线表示Al3+的物质的量的变化,故A正确;
B.由上述分析可知,随反应进行Al(OH)3物质的量先增大,或减小,故OC表示Al(OH)3的物质的量的变化,故B错误;
C.由上述分析可知,随反应进行Al(OH)3物质的量先增大,或减小,故CD线表示Al(OH)3的物质的量的变化,故C正确;
D.由上述分析可知,Al(OH)3溶解时,AlO2-的物质的量增大,BE线表示AlO2-的物质的量的变化,故D正确;
故选B.
点评 本题考查镁铝重要化合物、离子反应、化学计算等,难度较大,向含有1molAlCl3溶液中滴加NaOH溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+完全沉淀,消耗3molOH-,生成1molAl(OH)3,然后发生反应Al(OH)3+OH-=AlO2-+2H2O是解题的关键.

练习册系列答案
相关题目
2.氧族元素的各种性质可归纳整理出如表(部分):
回答下列问题:
(1)S2-的电子式为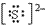 .
.
(2)氧元素比硫元素非金属性强(填强或弱).请用化学方程式证明该结论:2H2S+O2=2S↓+2H2O.
| 元素 性质 | 8O | 16S | Se | 52Te |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1 390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径(nm) | 0.074 | 0.102 | 0.116 | 0.143 |
| 单质与H2反应 | 点燃易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)S2-的电子式为
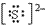 .
.(2)氧元素比硫元素非金属性强(填强或弱).请用化学方程式证明该结论:2H2S+O2=2S↓+2H2O.
20.用NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4LCHCl3中含有的氯原子的数目为3NA | |
| B. | 25℃、101kPa下,16gO3和O2混合气体中含有的氧原子数为NA | |
| C. | 等质量的N2和CO所含分子数相同且均为NA | |
| D. | 一定温度下,1L 1mol•L-1的CH3COONa溶液含NA个CH3COO- |
7.对于反应N2(g)+3H2O(g)═2NH3(g)+$\frac{3}{2}$O2(g),在不同时间段内所测反应速率见选项,则表示该化学反应进行最快的是( )
| A. | v(N2)=1.5 mol•(L•min)-1 | B. | v(NH3)=1.8 mol•(L•min)-1 | ||
| C. | v(H2O)=2.67 mol•(L•min)-1 | D. | v(O2)=1.5 mol•(L•min)-1 |
1.C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,下列做法不能加快化学反应速率的是( )
| A. | 增大氧气浓度 | B. | 升高反应温度 | C. | 增大木炭的量 | D. | 将炭磨成炭粉 |
2.某中学化学兴趣小组为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量的10%的稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水).有关实验数据如下表:
请计算(写出计算过程):
(1)该石灰石中碳酸钙的质量分数;
(2)参加反应10%的盐酸的质量.
| 反应前 | 反应后 | ||
| 实验 数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 134.4 g | 10 g | 141.1 g | |
(1)该石灰石中碳酸钙的质量分数;
(2)参加反应10%的盐酸的质量.

 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛. 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.