题目内容
16.向MgCl2和AlCl3混合溶液中逐滴滴加NaOH溶液至过量,下列图象正确的是( )| A. | 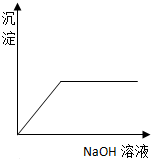 | B. | 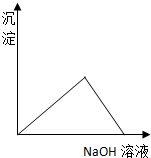 | ||
| C. | 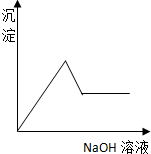 | D. | 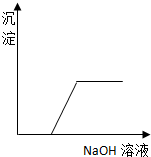 |
分析 MgCl2和AlCl3混合溶液中滴加NaOH溶液,生成两种沉淀:氢氧化镁和氢氧化铝,随着反应的进行沉淀量增大,但氢氧化铝溶于强碱,氯化镁和氯化铝完全转化为氢氧化物沉淀时,再继续加入氢氧化钠溶液,沉淀会部分溶解,据此分析.
解答 解:MgCl2和AlCl3混合溶液中滴加NaOH溶液,发生反应:Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓生成两种沉淀,沉淀量随着氢氧化钠的量增大而增大,但氯化镁和氯化铝完全转化为氢氧化物沉淀时,再继续加入氢氧化钠溶液,然后发生Al(OH)3+NaOH═NaAlO2+2H2O,随着氢氧化钠溶液的加入,沉淀量减少,但不会完全溶解,确定图象为C;
故选:C.
点评 本题考查化学反应与图象的关系,关键在于理解相关反应,熟练写出相应的反应的方程式,明确发生的化学反应及反应物的用量是解答的难点.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
6.实验室保存下列化学药品的方法不妥当的是( )
| A. | 将新制氯水保存在棕色试剂瓶中 | |
| B. | 将NaOH溶液保存在带玻璃塞的细口试剂瓶中 | |
| C. | 将少量钾、钠保存在煤油中 | |
| D. | 将浓硝酸溶液保存在棕色试剂瓶中 |
7.对于反应N2(g)+3H2O(g)═2NH3(g)+$\frac{3}{2}$O2(g),在不同时间段内所测反应速率见选项,则表示该化学反应进行最快的是( )
| A. | v(N2)=1.5 mol•(L•min)-1 | B. | v(NH3)=1.8 mol•(L•min)-1 | ||
| C. | v(H2O)=2.67 mol•(L•min)-1 | D. | v(O2)=1.5 mol•(L•min)-1 |
11.下列叙述正确的是( )
| A. | 硅酸盐材料的应用历史非常悠久,其中玻璃是人类最早应用的 | |
| B. | 水泥是一种重要的建筑材料,制备水泥和玻璃都需要用到石英 | |
| C. | 普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅 | |
| D. | 玻璃钢和钢都属于复合材料 |
1.C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,下列做法不能加快化学反应速率的是( )
| A. | 增大氧气浓度 | B. | 升高反应温度 | C. | 增大木炭的量 | D. | 将炭磨成炭粉 |
 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛. 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.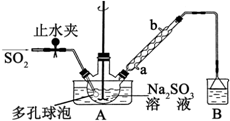 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图: