题目内容
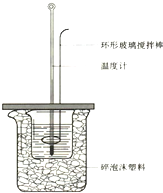 50mL 1.0mol?L-1盐酸跟50mL 1.1mol?L-1氢氧化钠溶液在如图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol?L-1盐酸跟50mL 1.1mol?L-1氢氧化钠溶液在如图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:(1)大小烧杯间填满碎泡沫塑料的作用
(2)
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是
(4)如果改用60mL 1.0mol?L-1盐酸跟50mL 1.1mol?L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量
(5)写出稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式(中和热数值为57.3kJ/mol)
考点:中和热的测定
专题:实验题
分析:(1)中和热测定实验成败的关键是保温工作;
(2)根据金属棒是热的良导体,易传热;
(3)不盖硬纸板,会有一部分热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)根据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
(2)根据金属棒是热的良导体,易传热;
(3)不盖硬纸板,会有一部分热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)根据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
解答:
解:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(2)不能将环形玻璃搅拌棒改为环形金属(如铜)棒,因为环形金属棒是热的良导体;
故答案为:不能;因为环形金属棒是热的良导体;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会偏低;
故答案为:偏低;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量增加,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关;
故答案为:增加;相等;
(5)强酸强碱的中和热为-57.3kJ/mol,即强酸和强碱的稀溶液完全反应生成1mol水放出的热量为57.3kJ,稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:HCl (aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:HCl (aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)不能将环形玻璃搅拌棒改为环形金属(如铜)棒,因为环形金属棒是热的良导体;
故答案为:不能;因为环形金属棒是热的良导体;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会偏低;
故答案为:偏低;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量增加,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关;
故答案为:增加;相等;
(5)强酸强碱的中和热为-57.3kJ/mol,即强酸和强碱的稀溶液完全反应生成1mol水放出的热量为57.3kJ,稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:HCl (aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:HCl (aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol.
点评:本题考查学生有关中和热的测定和热化学方程式的书写,注意中和热的概念,题目较简单.

练习册系列答案
相关题目
下列各化合物的命名中正确的是( )
| A、CH3CH=CH-CH=CH2(2,4一戊二:烯) |
| B、CH2Br-CH2Br(二溴乙烷) |
C、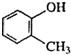 (甲基苯酚) (甲基苯酚) |
D、 (对甲基苯甲醇) (对甲基苯甲醇) |
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A、1.8克金属铝变为铝离子时失去的电子数目为0.1NA |
| B、1.8克818O2中所含的中子数目为NA |
| C、在常温常压下11.2升氯气所含的原子数目为NA |
| D、氧气的摩尔质量与NA个O2分子的质量相同 |
下列对葡萄糖性质的叙述中错误的是( )
| A、葡萄糖具有醇羟基,能和酸起酯化反应 |
| B、葡萄糖能使溴水褪色 |
| C、葡萄糖能被硝酸氧化 |
| D、葡萄糖能水解生成乙醇 |