题目内容
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
(1)基态溴原子的价电子排布式为 .
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近.则Cl2、IBr、ICl的沸点由高到低的顺序为 .
(3)气态氟化氢中存在二聚分子(HF)2,这是由于 .
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 ,中心原子杂化类型为 .
(5)①HClO4、②HIO4、③H5IO6〔可写成(HO)5IO〕的酸性由强到弱的顺序为 (填序号).
(6)IBr和水能发生反应,生成物中有一种为三原子分子,写出该化合物的结构式 .
(1)基态溴原子的价电子排布式为
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近.则Cl2、IBr、ICl的沸点由高到低的顺序为
(3)气态氟化氢中存在二聚分子(HF)2,这是由于
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为
(5)①HClO4、②HIO4、③H5IO6〔可写成(HO)5IO〕的酸性由强到弱的顺序为
(6)IBr和水能发生反应,生成物中有一种为三原子分子,写出该化合物的结构式
考点:原子核外电子排布,晶体熔沸点的比较,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)根据溴的原子的质子数为35,由能量最低原理书写价电子排布式;
(2)Cl2、BrI、ICl结构相似,都是可以形成分子晶体,相对分子质量越大,范德华力越强,物质的沸点越高;
(3)F元素电负性很强,气态HF分子间形成氢键;
(4)I3+可看成II2+,中心I原子的价层电子对数为=
=4,中心I原子的孤电子对数为
=2,据此判断;
(5)非金属性越强,则对应最高价含氧酸的酸性就强,同种元素的含氧酸,利用非羟基氧个数来判断酸性;
(6)IBr和水能发生反应生成HIO与HBr,HIO中O原子与H、I原子之间分别形成1对共用电子对.
(2)Cl2、BrI、ICl结构相似,都是可以形成分子晶体,相对分子质量越大,范德华力越强,物质的沸点越高;
(3)F元素电负性很强,气态HF分子间形成氢键;
(4)I3+可看成II2+,中心I原子的价层电子对数为=
| 7+1×2-1 |
| 2 |
| 7-1-1×2 |
| 2 |
(5)非金属性越强,则对应最高价含氧酸的酸性就强,同种元素的含氧酸,利用非羟基氧个数来判断酸性;
(6)IBr和水能发生反应生成HIO与HBr,HIO中O原子与H、I原子之间分别形成1对共用电子对.
解答:
解:(1)溴的原子的质子数为35,核外电子数为35,由核外电子排布规律可知,其电子排布式为1s22s22p63s23p63d104s24p5,故其价电子排布式为:4s24p5,
故答案为:4s24p5;
(2)Cl2、BrI、ICl结构相似,都是可以形成分子晶体,因相对分子质量BrI>ICl>Cl2 ,则范德华力BrI>ICl>Cl2 ,故沸点:BrI>ICl>Cl2,
故答案为:BrI>ICl>Cl2;
(3)因F的电负性最大,则HF分子中存在氢键形成二聚分子,
故答案为:HF分子间形成氢键;
(4)I3+可看成II2+,中心I原子的价层电子对数为=
=4,中心I原子的孤电子对数为
=2,则I3+的空间构型为V形,中心I原子采取sp3杂化,
故答案为:V形;sp3;
(5)因非金属性Cl>I,非金属性越强,则对应的最高价氧化物的酸性越强,则①的酸性最强,在②③中都是碘元素的含氧酸,非羟基氧个数越多,酸性越强,则酸性到为②>③,
故答案为:①>②>③;
(6)IBr和水能发生反应生成HIO与HBr,HIO中O原子与H、I原子之间分别形成1对共用电子对,其结构式为H-O-I,
故答案为:H-O-I.
故答案为:4s24p5;
(2)Cl2、BrI、ICl结构相似,都是可以形成分子晶体,因相对分子质量BrI>ICl>Cl2 ,则范德华力BrI>ICl>Cl2 ,故沸点:BrI>ICl>Cl2,
故答案为:BrI>ICl>Cl2;
(3)因F的电负性最大,则HF分子中存在氢键形成二聚分子,
故答案为:HF分子间形成氢键;
(4)I3+可看成II2+,中心I原子的价层电子对数为=
| 7+1×2-1 |
| 2 |
| 7-1-1×2 |
| 2 |
故答案为:V形;sp3;
(5)因非金属性Cl>I,非金属性越强,则对应的最高价氧化物的酸性越强,则①的酸性最强,在②③中都是碘元素的含氧酸,非羟基氧个数越多,酸性越强,则酸性到为②>③,
故答案为:①>②>③;
(6)IBr和水能发生反应生成HIO与HBr,HIO中O原子与H、I原子之间分别形成1对共用电子对,其结构式为H-O-I,
故答案为:H-O-I.
点评:本题综合性较大,考查核外电子排布规律、分子结构与性质、熔沸点比较等,明确沸点的比较方法、氢键对物质性质的影响,需要学生具备扎实的知识和分析问题解决问题的能力,难度较大,(4)中构型判断是难点、易错点.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
在同温同压下,一定量的某有机物和过量的金属钠反应产生a L氢气,另取等量的该有机物与足量的小苏打溶液反应,可以收集二氧化碳气体b L,若a=b,则该有机物可能是( )
| A、HOOC-COOH |
| B、HOOC-CH2CH2OH |
| C、HOCH2-CH2OH |
| D、CH3COOH |
下列关于煤和石油的说法正确的是( )
| A、煤和石油均属于可再生矿物能源 |
| B、煤经干馏再分馏可获得芳香烃 |
| C、石油分馏得到的各馏分均是纯净物 |
| D、石油裂解的目的是为了提高汽油的产量与质量 |
 四种有机物
四种有机物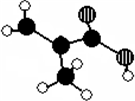 某化工厂生产的某产品只含C、H、O三种元素,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等).
某化工厂生产的某产品只含C、H、O三种元素,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等).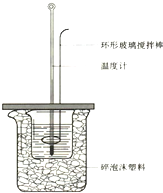 50mL 1.0mol?L-1盐酸跟50mL 1.1mol?L-1氢氧化钠溶液在如图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol?L-1盐酸跟50mL 1.1mol?L-1氢氧化钠溶液在如图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题: