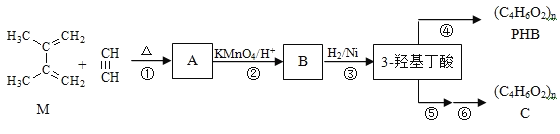
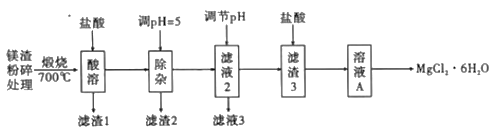
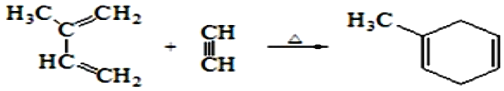题目内容
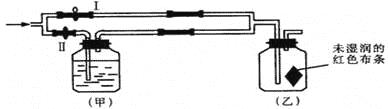
【题目】钠是一种应用广泛的金属,钠及其化合物在生产生活中应用广泛。某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
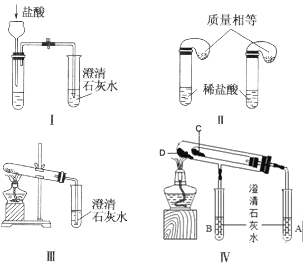
(1)只根据图中装置Ⅰ、Ⅱ所示实验,能够达到实验目的的是__(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式__、__;Ⅳ中现象为___;与实验Ⅲ相比,实验Ⅳ的优点___。
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管C中装入的固体是__(填化学式)。
(4)将适量钠投入下列溶液中,既能产生大量气体又能生成沉淀的是__(填写字母)
A.稀硫酸 B.氯化钠溶液 C.氯化镁溶液 D.硫酸铜溶液
【答案】Ⅱ 2NaHCO3![]() Na2CO3+CO2↑+H2O CO2+Ca(OH)2=CaCO3↓+H2O 加热时B中澄清石灰水不变浑浊,A中变浑浊,说明Na2CO3比NaHCO3稳定 Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 NaHCO3 CD
Na2CO3+CO2↑+H2O CO2+Ca(OH)2=CaCO3↓+H2O 加热时B中澄清石灰水不变浑浊,A中变浑浊,说明Na2CO3比NaHCO3稳定 Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 NaHCO3 CD
【解析】
(1)无论碳酸钠还是碳酸氢钠,都能和盐酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,现象相同,但碳酸钠和盐酸反应分两步进行,反应生成CO2所消耗的时间较长,据此分析;
(2)碳酸氢钠受热分解生成碳酸钠、水和CO2,将CO2通入澄清石灰水中,石灰水变浑浊;装置Ⅳ中C试管内装有碳酸氢钠,D试管中装有碳酸钠,根据澄清石灰水中的现象可判断物质种类;
(3)装置Ⅳ中C试管内装有碳酸氢钠,D试管中装有碳酸钠;
(4)A.金属与酸反应生成氢气;
B. 将适量钠投入氯化钠溶液中,钠只与水反应;
C. 将适量钠投入氯化镁溶液中,钠先与水反应生成氢氧化钠,生成的氢氧化钠与氯化镁反应生成白色沉淀;
D. 将适量钠投入硫酸铜溶液中,钠先与水反应生成氢氧化钠,生成的氢氧化钠与硫酸铜反应生成蓝色沉淀。
(1)无论碳酸钠还是碳酸氢钠,都能和盐酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,现象相同,但碳酸钠和盐酸反应分两步进行,反应生成CO2所消耗的时间较长,可根据气球膨胀的速度判断,因此装置Ⅱ可以达到实验目的;
(2)碳酸氢钠受热分解生成碳酸钠、水和CO2,反应方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O,将CO2通入澄清石灰水中,石灰水变浑浊,发生的反应为:CO2+Ca(OH)2=CaCO3↓+H2O;装置Ⅳ中C试管内装有碳酸氢钠,D试管中装有碳酸钠,加热后试管B中没有现象,试管A中变浑浊,能证明碳酸钠的稳定性强于碳酸氢钠;利用装置Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行;
Na2CO3+CO2↑+H2O,将CO2通入澄清石灰水中,石灰水变浑浊,发生的反应为:CO2+Ca(OH)2=CaCO3↓+H2O;装置Ⅳ中C试管内装有碳酸氢钠,D试管中装有碳酸钠,加热后试管B中没有现象,试管A中变浑浊,能证明碳酸钠的稳定性强于碳酸氢钠;利用装置Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行;
(3)装置Ⅳ中C试管内装有碳酸氢钠,D试管中装有碳酸钠;
(4)A.金属钠与硫酸反应生成硫酸钠和氢气,只有气泡生成,A项错误;
B. 将适量钠投入氯化钠溶液中,钠只与水反应,生成氢氧化钠和氢气,能看到有气泡生成,B项错误;
C. 将适量钠投入氯化镁溶液中,钠先与水反应生成氢氧化钠,生成的氢氧化钠与氯化镁反应生成白色沉淀,方程式为:2Na+2H2O+MgCl2=2NaCl+Mg(OH)2↓+H2↑,既有气体又有沉淀,C项正确;
D. 将适量钠投入硫酸铜溶液中,钠先与水反应生成氢氧化钠,生成的氢氧化钠与硫酸铜反应生成蓝色沉淀,反应方程式为:2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑,既有气体又有沉淀,D项正确;
答案选CD。
生成气体型 | 钠与NH4Cl溶液反应生成H2和NH3 |
生成沉淀型 | 钠与铜盐、铁盐等溶液反应生成Cu(OH)2或Fe(OH)3 |
复杂型 | 钠与AlCl3稀溶液反应,如果钠量较多,则先生成Al(OH)3沉淀,后沉淀溶解 |

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】实验室用乙酸和正丁醇制备乙酸正丁酯,有关物质的相关数据如下:
化合物 | 密度/gcm-3 | 沸点/℃ | 溶解度/100g水 |
正丁醇 | 0.810 | 118.0 | 9 |
冰醋酸 | 1.049 | 118.1 | 互溶 |
乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
I.乙酸正丁酯粗产品的制备
在干燥的A中,装入沸石,加入11.5mL正丁醇和9.4mL冰酷酸,再加3~4滴浓硫酸,然后安装分水器(作用:实验过程中不断分离除去反应生成的水)。温度计及回流冷凝管,热冷凝回流反应。
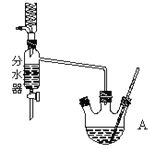
(1)实验过程中可能产生多种有机副产物。写出其中两种的结构简式:_________。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是:_________。
II.乙酸正丁酯粗产品的制备
(3)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗,②蒸馏,③用无水MgSO4干燥,④用10%碳酸钠洗涤,正确的操作步骤是_________。
a ①②③④ b ③①④② c ①④①③② d ④①③②③
(4)将酯层采用下图所示装置蒸馏,图中仪器B的名称___________。冷却水从______口进入(填字母),蒸馏收集乙酸正丁酯产品时,应将温度控制在_________左右。
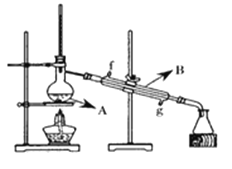
III.计算产率
(5)测量分水器内由乙酸与正丁醇反应生成的水体积为1.8mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率______。
【题目】298 K时,![]() γ-羟基丁酸水溶液发生如下反应,生成
γ-羟基丁酸水溶液发生如下反应,生成![]() 丁内酯: HOCH2CH2CH2COOH
丁内酯: HOCH2CH2CH2COOH![]()
![]() +H2O
+H2O
不同时刻测得![]() 丁内酯的浓度如下表。
丁内酯的浓度如下表。
| 20 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是
A.增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B.298 K时,该反应的平衡常数为2.75
C.反应至120 min时,γ-羟基丁酸的转化率<50%
D.80~120 min的平均反应速率:v(γ-丁内酯) >1.2×10-3 mol L-1min-1