题目内容
15.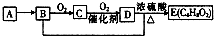 已知,有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平.A、B、C、D、E有如图转化关系则下列推断错误的是( )
已知,有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平.A、B、C、D、E有如图转化关系则下列推断错误的是( )| A. | 鉴别A和甲烷可选择使用酸性高锰酸钾溶液 | |
| B. | D中含有羧基,利用D物质可以清除水壶中的水垢 | |
| C. | 图表涉及的反应类型有加成、取代、氧化 | |
| D. | B+D→E的化学方程式:C2H5OH+CH3COOH→CH3COOC2H5 |
分析 化合物A只由碳、氢两种元素组成,能使溴水褪色,其产量用来衡量一个国家石油化工发展水平,则A是乙烯,B能被氧化生成C,C能被氧化生成D,B和D能反应生成E,则B是乙醇,C是乙醛,D是乙酸,乙醇和乙酸反应生成乙酸乙酯,即为E物质.
解答 解:化合物A只由碳、氢两种元素组成,能使溴水褪色,其产量用来衡量一个国家石油化工发展水平,则A是乙烯,B能被氧化生成C,C能被氧化生成D,B和D能反应生成E,则B是乙醇,C是乙醛,D是乙酸,乙醇和乙酸反应生成乙酸乙酯,即为E物质,
A.乙烯可以使酸性高锰酸钾溶液褪色,甲烷不可以,故A正确;
D.D为醋酸,含有羧基,醋酸酸性比较碳酸强,醋酸可以与水垢的主要成分反应,故B正确;
C.由上述分析可知,在上述各物质转化中,A发生加成反应得B,B氧化得C,C氧化得D,D发生酯化(取代)得E,所以涉及的反应类型有加成、取代、氧化,故C正确;
D.B+D→E的化学方程式为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O,故D错误,
故选D.
点评 本题考查了有机物的推断,注意根据B能连续氧化,再结合B与D的产物推断,难度不大,D选项为易错点,学生容易忽略水.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.某有机物能使溴水褪色,也能在一定条件下发生水解生成两种有机物,还能发生加聚反应生成高分子化合物,则此有机物中一定含有下列基团的组合是( )
①-CH3;②-OH;③-Cl;④-CHO;⑤-C2H3;⑥-COOH;⑦-COOCH3.
①-CH3;②-OH;③-Cl;④-CHO;⑤-C2H3;⑥-COOH;⑦-COOCH3.
| A. | ①③ | B. | ②⑥ | C. | ⑤⑦ | D. | ④⑤ |
3.下列名词不是物理量专有名词的是( )
| A. | 时间 | B. | 物质的量 | C. | 质量 | D. | 摩尔 |
20.下列关于氯水的叙述中,正确的是( )
| A. | 新制氯水中只含Cl2和H2O两种分子 | |
| B. | 新制氯水可使紫色石蕊溶液先变红后褪色 | |
| C. | 久置的氯水pH增大,酸性增强 | |
| D. | 氯水经光照有气泡逸出,该气体是Cl2 |
7.四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
(1)写出C原子的基态电子排布式[Ar]3d104s1.D中成对电子数与未成对电子数之比为2:1.
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点高(填“高”或“低”),其原因氨气分子之间存在氢键.
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是CO2为分子晶体,SiO2是原子晶体.
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为[Cu(NH3)4]SO4,该配合物中存在的化学键类型是ABD.(填字母)
A、离子键 B、共价键 C、金属键 D、配位键 E、分子间作用力
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“O”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键.
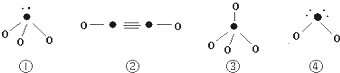
则在以上分子中,中心原子采用sp3杂化的是①③④;属于极性分子的是①④.(以上均填写序号).在②的分子中有3个σ键和2个π键.
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点高(填“高”或“低”),其原因氨气分子之间存在氢键.
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是CO2为分子晶体,SiO2是原子晶体.
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为[Cu(NH3)4]SO4,该配合物中存在的化学键类型是ABD.(填字母)
A、离子键 B、共价键 C、金属键 D、配位键 E、分子间作用力
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“O”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键.
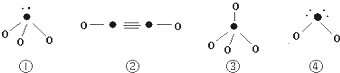
则在以上分子中,中心原子采用sp3杂化的是①③④;属于极性分子的是①④.(以上均填写序号).在②的分子中有3个σ键和2个π键.
8.下列有关海水提溴的叙述中,不正确的是( )
| A. | 利用空气吹出法提溴的过程为氯化→吹出→吸收 | |
| B. | 海水中的溴是以Br2形式存在,利用空气吹出法可获得Br2 | |
| C. | 吸收过程中,先用SO2将Br2还原为HBr,再用Cl2氧化HBr得到Br2 | |
| D. | 氯化过程发生的反应为2Br-+Cl2═Br2+2Cl- |
 它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简
它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简 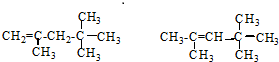 .
.