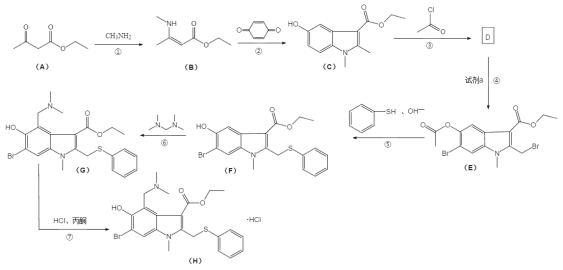
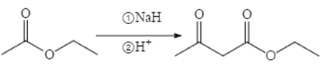
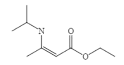
题目内容
【题目】工业含铬(Ⅵ)污水能污染水源,被人体吸收后易积累而导致器官癌变,必须经无害化处理后才能排放。青岛某污水处理厂的工艺流程如图:
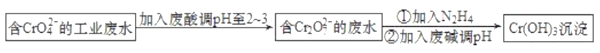
回答下列问题:
(1)CrO42-氧化性较弱,酸性条件下转化为具有较强氧化性的Cr2O72-的离子方程式为__。
(2)已知N2H4与Cr2O72-反应生成无毒气体。若要处理Cr2O72-浓度为0.01mol·L-1的废水1m3,至少需要加入N2H4__kg。
(3)含有SO32-的废水可以代替N2H4处理酸性含铬(Ⅵ)废水,用离子方程式表示其反应原理__。
(4)Cr(OH)3的化学性质与Al(OH)3相似。上述流程中“②加入废碱调pH”时要控制溶液的pH不能过高,原因是__。
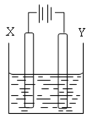
(5)含铬(Ⅵ)污水也可用电解法处理。用铁和石墨作电极电解污水,Cr2O72-在阳极区转化为Cr3+,随着电解的进行,溶液pH逐渐增大,Cr3+转化为Cr(OH)3沉淀除去。
①该电解装置中用___作阳极,阳极区除生成Cr(OH)3外还有_沉淀(写化学式)。
②阴极电极反应式为__。
【答案】2CrO42-+2H+=Cr2O72-+H2O 0.48 Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O 过量的碱能够使Cr(OH)3沉淀转变为可溶性的[Cr(OH)4]-{或Cr(OH)3+OH-=[Cr(OH)4]-} 铁(Fe) Fe(OH)3 2H++2e-=H2↑(或2H2O+2e-=2OH-+H2↑)
【解析】
含CrO42-的工业废水加入废酸调pH至2~3,发生2CrO42-(黄色)+2H+===Cr2O72-(橙色)+H2O,得到含Cr2O72-的废水,加入N2H4处理酸性废水,发生氧化还原反应生成Cr3+,加入废碱调节pH,可生成Cr(OH)3沉淀,以此解答该题。
(1)CrO42-氧化性较弱,酸性条件下转化为具有较强氧化性的Cr2O72-的离子方程式为2CrO42-+2H+===Cr2O72-+H2O;
(2)N2H4与Cr2O72-反应生成无毒气体,应生成氮气,反应中N元素化合价由-2价升高到0价,Cr元素化合价由+6价降低到+3价,若要处理Cr2O72-浓度为0.01molL-1的废水1m3,根据电子守恒可知n(Cr2O72-)=0.01mol/L×1000L=10mol,则得到60mol电子,可知需要N2H4的物质的量为![]() =15mol,质量为15mol×32g/mol=480g=0.48kg;
=15mol,质量为15mol×32g/mol=480g=0.48kg;
(3)含有SO32-的废水可以代替N2H4处理酸性含铬(Ⅵ)废水,Cr2O72-将二氧化硫氧化为硫酸根,根据电子守恒和元素守恒可知反应的离子方程式为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O;
(4)Cr(OH)3的化学性质与Al(OH)3相似,如果氢氧化钠过量Cr(OH)3会溶解,发生离子方程式为Cr(OH)3+OH-=[Cr(OH)4]-;
(5)①电解时,Fe为阳极,发生氧化反应生成Fe2+,与Cr2O72-发生氧化还原反应生成Fe3+,阳极区除生成Cr(OH)3外还有Fe(OH)3;
②阴极发生还原反应生成氢气,电极方程式为2H2O+2e-=2OH-+H2↑,