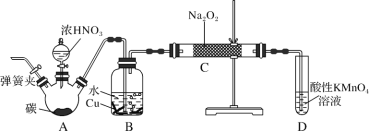
题目内容
【题目】(1)请写出高温时铁和水蒸气反应的化学方程式:_______________。
(2)写出碳酸氢钠溶液中滴入氢氧化钠溶液的离子方程式:___________。
(3)装氢氧化钠溶液的试剂瓶不能用玻璃塞,请用离子方程式表示原因:______。
(4)写出镁条在足量的二氧化碳中燃烧的化学方程式:_______________。
【答案】3Fe + 4H2O![]() Fe3O4 + 4H2 HCO3- + OH-=CO32-+H2O 2OH-+SiO2=H2O+SiO32- 2Mg+CO2
Fe3O4 + 4H2 HCO3- + OH-=CO32-+H2O 2OH-+SiO2=H2O+SiO32- 2Mg+CO2![]() 2MgO+C
2MgO+C
【解析】
(1)高温时铁和水蒸气反应生成四氧化三铁和氢气的化学方程式为3Fe + 4H2O![]() Fe3O4 + 4H2;
Fe3O4 + 4H2;
(2)碳酸氢钠溶液中滴入氢氧化钠溶液生成碳酸钠和水,发生反应的离子方程式为HCO3- + OH-=CO32-+H2O;
(3)氢氧化钠与玻璃塞中的二氧化硅反应生成粘性物质硅酸钠,反应的离子方程式为:2OH-+SiO2=H2O+SiO32-;
(4)镁条在足量的二氧化碳中燃烧生成MgO和C,发生反应的化学方程式为2Mg+CO2![]() 2MgO+C。
2MgO+C。

 口算能手系列答案
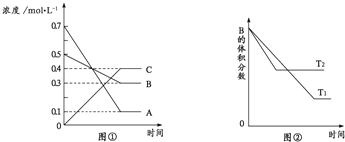
口算能手系列答案【题目】I某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验 序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/mol﹒L-1 | V mL | c/mol﹒L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)写出草酸与高锰酸钾反应的离子方程式____________________________________。
(2)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=________、T1=________;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=________。
(3)若t1<8,则由此实验可以得出的结论是______________________________________;忽略溶液体积的变化,利用实验B中数据计算,0-8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)________。
Ⅱ催化剂在生产和科技领域起到重大作用。某化学研究小组的同学分别设计了如图所示的实验,用控制变量法比较Fe3+和Cu2+对H2O2分解的催化效果。请回答相关问题:
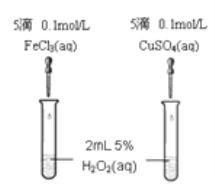
(4)定性某同学通过观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,该结论_____填 (“合理”或“不合理”),原因________________。
(5)向50ml H2O2溶液中加入0.10molMnO2粉末,在标准状况下放出气体的体积和时间的关系如图所示。
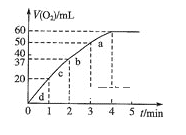
①实验中放出气体的总体积是 __________mL。
②H2O2的初始物质的量浓度是____________(保留2位有效数字)。
③a、d两段反应速率大小的顺序为_____>_____,原因_____________________________。