题目内容
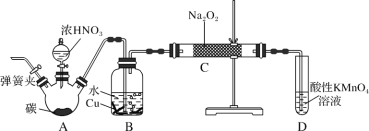
【题目】亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如图装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠(夹持装置和A中加热装置已略,气密性已检验)。
查阅资料:
①HNO2为弱酸,室温下存在反应:3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成;
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
(1)B中观察到的主要现象是_______,D装置的作用是_______。
(2)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。生成碳酸钠的化学方程式是_______。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是_______ (写名称)。
【答案】溶液变蓝,铜片溶解,导管口有无色气体冒出 除去剩余一氧化氮防止污染空气 2CO2+2Na2O2═2Na2CO3+O2 碱石灰
【解析】
(1)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
CO2↑+4NO2↑+2H2O,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
(2)生成碳酸钠的反应是二氧化碳和过氧化钠发生的反应,生成碳酸钠和氧气;为排除干扰在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳。
(1)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,硝酸和铜反应生成硝酸铜,一氧化氮和水,所以反应现象为溶液变蓝,铜片溶解,导管口有无色气体冒出;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
(2)生成碳酸钠的反应是二氧化碳和过氧化钠发生的反应,反应的化学方程式为:2CO2+2Na2O2═2Na2CO3+O2,通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,一氧化氮是污染性气体,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;为排除干扰在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳。

【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
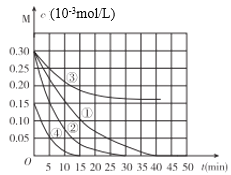
实验编号 | 温度°C | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验①④说明M的浓度越小,降解的速率越快