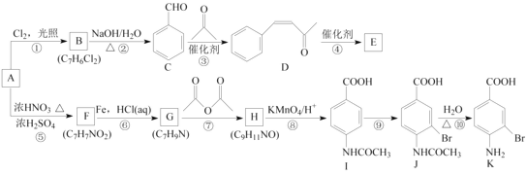
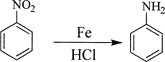
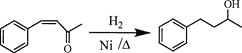
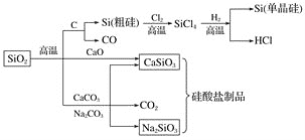
题目内容
【题目】I某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验 序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/mol﹒L-1 | V mL | c/mol﹒L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)写出草酸与高锰酸钾反应的离子方程式____________________________________。
(2)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=________、T1=________;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=________。
(3)若t1<8,则由此实验可以得出的结论是______________________________________;忽略溶液体积的变化,利用实验B中数据计算,0-8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)________。
Ⅱ催化剂在生产和科技领域起到重大作用。某化学研究小组的同学分别设计了如图所示的实验,用控制变量法比较Fe3+和Cu2+对H2O2分解的催化效果。请回答相关问题:
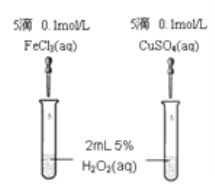
(4)定性某同学通过观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,该结论_____填 (“合理”或“不合理”),原因________________。
(5)向50ml H2O2溶液中加入0.10molMnO2粉末,在标准状况下放出气体的体积和时间的关系如图所示。
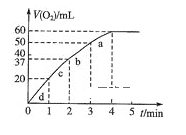
①实验中放出气体的总体积是 __________mL。
②H2O2的初始物质的量浓度是____________(保留2位有效数字)。
③a、d两段反应速率大小的顺序为_____>_____,原因_____________________________。
【答案】2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O 浓度 1 293 BC 3 其他条件相同时,增大反应物浓度,反应速率增大 8.3×10-4mol﹒L-1﹒s-1 不合适 阴离子不相同 60 0.11mol/L d a 随着反应的进行,H2O2浓度减小,反应速率变慢。
【解析】
(1)草酸与高锰酸钾反应生成二氧化碳和锰盐;
(2)A、B应控制温度相同,探究浓度对反应速率的影响,B、C温度不同可探究温度对反应速率的影响,研究某种因素对反应速率的影响时,需要保证气体条件相同;
(3)若t1<8,则浓度越大,反应速率越大;结合v=![]() 计算;
计算;
(4)比较反应速率的大小可通过生成气泡的快慢来判断,比较金属阳离子的催化效果要排除阴离子的干扰;
(5)①根据图象确定生成氧气的体积;
②根据氧气的量计算双氧水的物质的量,再根据c=![]() 计算双氧水的物质的量浓度;
计算双氧水的物质的量浓度;
③根据图象结合v=![]() 知,a、b、c、d各点反应速率快慢的顺序为:d>c>b>a;
知,a、b、c、d各点反应速率快慢的顺序为:d>c>b>a;
反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小。
(1)草酸与高锰酸钾反应生成二氧化碳和锰盐,离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O。
(2)实验A、B,滴加H2C2O4溶液的体积不等,故实验A、B可探究出H2C2O4浓度的改变对反应速率的影响;
据实验A可知,保证溶液的总体积为6mL,B中H2C2O4溶液3mL,故需加水6mL-2mL-3mL=1mL;
A、B研究浓度对化学反应速率的影响,需要温度相同,故T1=293;
B、C温度不同,要探究出温度变化对化学反应速率的影响,其余条件相同,则V2=6mL-2mL-1mL=3mL;
(3)若t1<8,则由此实验可以得出的结论是其他条件相同时,增大反应物浓度,反应速率增大;
根据实验B中数据可知,高锰酸钾完全反应需要的时间为8s,高锰酸钾的物质的量为0.02mol·L-1×0.002L=0.00004mol,混合后溶液中高锰酸钾的浓度为0.00004mol÷0.006L=![]() ×10-3mol·L-1,则用KMnO4的浓度变化表示的反应速率为
×10-3mol·L-1,则用KMnO4的浓度变化表示的反应速率为
![]() ×10-3mol·L-1÷8s=8.3×10-4mol/(L·s);
×10-3mol·L-1÷8s=8.3×10-4mol/(L·s);
(4)如图甲可通过观察产生气泡的快慢,定性比较得出催化剂的催化效果;催化剂能改变化学反应的速率,这里是加快速率,若图1所示实验中反应速率为①>②,则一定说明氯化铁比硫酸铜催化效果好,因二者所含的阴离子不同,要证明Fe3+比Cu2+对H2O2分解催化效果好,还要使选择的试剂中阴离子种类相同,所以得出Fe3+和Cu2+对H2O2分解的催化效果,所以其结论不合理;
(5)①根据图象知,第4分钟时,随着时间的推移,气体体积不变,所以实验时放出气体的总体积是60 mL;
②设双氧水的物质的量为x,
2H2O2![]() 2H2O+O2↑
2H2O+O2↑
2mol 22.4L
x 0.06L
x=2mol×0.06L÷22.4L=0.0054mol,
所以其物质的量浓度=0.0054mol÷0.05L=0.11 mol·L-1;
③根据图象结合v=![]() 知,a、b、c、d各点反应速率快慢的顺序为:d>c>b>a;
知,a、b、c、d各点反应速率快慢的顺序为:d>c>b>a;
反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小。

 阅读快车系列答案
阅读快车系列答案