题目内容
14.下列表示物质结构的化学用语或模型正确的是( )| A. | HF的电子式: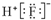 | |
| B. | 二氧化碳的结构式:O=C=O | |
| C. | Cl-离子的结构示意图: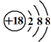 | |
| D. | 质子数为6,中子数为8的微粒:${\;}_{6}^{8}$C |
分析 A.氟化氢为共价化合物,不存在阴阳离子,其电子式不能标出电荷;
B.二氧化碳分子中存在两个碳氧双键;
C.氯离子的核电荷数为17,不是18;
D.元素符号的左上角表示质量数,质量数=质子数+中子数.
解答 解:A.B.氟化氢分子中不存在阴阳离子,其正确的电子式为 ,故A错误;
,故A错误;
B.二氧化碳的电子式为: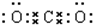 ,则二氧化碳的结构式为:O=C=O,故B正确;
,则二氧化碳的结构式为:O=C=O,故B正确;
C.氯离子核电荷数为17,核外电子总数为18,氯离子结构示意图为 ,故C错误;
,故C错误;
D.质子数为6,中子数为8的微粒的质量数为14,该核素可以表示为:614C,故D错误;
故选B.
点评 本题考查电子式、离子结构示意图、结构式、元素符号的书写判断,题目难度中等,注意掌握常见的化学用语的概念及正确表示方法,明确离子结构示意图与原子结构示意图的区别,试题有利于提高学生规范答题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.进行简单类推的思维方法不一定都能得到正确结论,因此类推的结论最终要经过实践的检验才能决定其正确与否.下列几种类推结论中正确的是( )
| A. | 可电解熔融MgCl2来制取金属镁,也能电解熔融HCl来制取Cl2 | |
| B. | 卤族元素的单质从F2到I2的熔点逐渐升高,则碱金属元素单质从Li到Cs的熔点也逐渐升高 | |
| C. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序是HCl>H2S>PH3 | |
| D. | 少量的Cl2通入FeBr2溶液中生成FeCl3和FeBr3,则少量的Cl2通入FeI2 溶液中也生成FeCl3和FeI3 |
5.下列离子能大量共存,通入足量SO2后,所含离子仍能大量共存的是( )
| A. | NH4+、Al3+、SO42-、AlO2- | B. | Na+、SO32-、Cl-、K+ | ||
| C. | Na+、NH4+、SO42-、Cl- | D. | K+、I-、Cl-、NO3- |
2.下列除去杂质的方法错误的是( )
| A. | 除去KCl中混有的KI:溶于水通入过量氯气,蒸发结晶 | |
| B. | 除去BaSO4固体中混有的BaCO3:加过量盐酸后,过滤 | |
| C. | 除去Na2CO3固体中的NaHCO3:加热至恒重 | |
| D. | 除去CuO中混有的Al2O3:加过量盐酸后,过滤 |
9.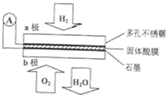 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )| A. | 电子通过外电路从a极流向b极 | |
| B. | b极上的电极反应式为:O2+4H++4e-═2H2O | |
| C. | H+由b极通过固体酸电解质传递到a极 | |
| D. | 每转移0.1 mol电子,标准状况下需消耗1.12L的H2 |
19.由乙烯推测丙烯(CH2=CH-CH3)的结构或性质正确的是( )
| A. | 不能使酸性高锰酸钾溶液褪色 | |
| B. | 不能在空气中燃烧 | |
| C. | 能使溴水褪色 | |
| D. | 与HCl在一定条件下能加成只得到一种产物 |
6.实验室用铜和浓硫酸反应制取二氧化硫,下列有关该反应的说法错误的是( )
| A. | 铜是还原剂,发生了氧化反应 | |
| B. | 每生成1 mol SO2,转移电子的物质的量是2 mol | |
| C. | 每消耗 1 mol Cu,起氧化剂作用的硫酸消耗2 mol | |
| D. | 反应后物质中可能有白色固体出现 |
3.下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、碱性、澄清溶液的是( )
| A. | Fe3+、Na+、Cl-、S2- (1:2:3:1) | B. | K+、Cu2+、OH-、SO42- (1:1:1:1) | ||
| C. | NH4+、H+、I -、HCO3- (1:1:1:1) | D. | Na+、Al 3+、Cl -、OH-(4:1:3:4) |
4.下面有关晶体的叙述中,错误的是( )
| A. | 金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 | |
| B. | 在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或6个Na+) | |
| C. | 白磷晶体中,粒子之间通过共价键结合,键角为60° | |
| D. | 离子晶体在熔化时,离子键被破坏;而分子晶体熔化时,化学键不被破坏 |