题目内容
对于反应aA+bB=dD+eE,该化学反应速率定义为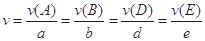 。式中
。式中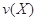 指物质
指物质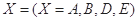 的反应速率,
的反应速率,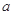 、
、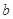 、
、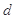 、
、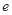 是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
以下说法正确的是
A.实验1、2中,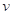 (H2O2)相等
(H2O2)相等
B.将浓度均为0.200 mol·L-1H2O2和HI溶液等体积混合,反应开始时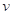 ="0.0304" mol·L-1·s-1
="0.0304" mol·L-1·s-1
C.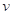 与“HI和H2O2浓度的乘积”的比值为常数
与“HI和H2O2浓度的乘积”的比值为常数
D.实验4,反应5秒后H2O2浓度减少了0.0755 mol·L-1
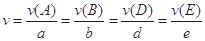 。式中
。式中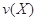 指物质
指物质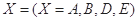 的反应速率,
的反应速率,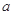 、
、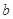 、
、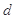 、
、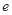 是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:| 实验编号 | 1 | 2 | 3 | 4 |
| c(HI)/ mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 |
| c(H2O2)/ mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 |
| v/ mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 |
A.实验1、2中,
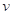 (H2O2)相等
(H2O2)相等B.将浓度均为0.200 mol·L-1H2O2和HI溶液等体积混合,反应开始时
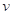 ="0.0304" mol·L-1·s-1
="0.0304" mol·L-1·s-1C.
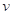 与“HI和H2O2浓度的乘积”的比值为常数
与“HI和H2O2浓度的乘积”的比值为常数D.实验4,反应5秒后H2O2浓度减少了0.0755 mol·L-1
C
试题分析:A、实验1、2中v值不同,则根据v的表达式可知实验1、2中,
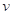 (H2O2)不相等,A不正确;B、将浓度均为0.200 mol·L-1H2O2和HI溶液等体积混合后浓度均变为0.100mol/L,因此反应开始时
(H2O2)不相等,A不正确;B、将浓度均为0.200 mol·L-1H2O2和HI溶液等体积混合后浓度均变为0.100mol/L,因此反应开始时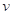 不可能等于0.0304 mol·L-1·s-1,B不正确;C、根据表中数据可知实验1~4中
不可能等于0.0304 mol·L-1·s-1,B不正确;C、根据表中数据可知实验1~4中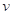 与“HI和H2O2浓度的乘积”的比值分别为0.760、0.765、0.757、0.755,因此
与“HI和H2O2浓度的乘积”的比值分别为0.760、0.765、0.757、0.755,因此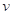 与“HI和H2O2浓度的乘积”的比值为常数,C正确;D、根据v的表达式可知实验4中双氧水的初始反应速率是0.0151 mol·L-1·s-1,因此反应5秒后H2O2浓度一定不是减少了0.0151 mol·L-1·s-1×5s=0.0755 mol·L-1,D不正确,答案选C。
与“HI和H2O2浓度的乘积”的比值为常数,C正确;D、根据v的表达式可知实验4中双氧水的初始反应速率是0.0151 mol·L-1·s-1,因此反应5秒后H2O2浓度一定不是减少了0.0151 mol·L-1·s-1×5s=0.0755 mol·L-1,D不正确,答案选C。
练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
 2C(g),下列各数据表示同一反应速率是
2C(g),下列各数据表示同一反应速率是  CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下: ΔH=+8.0kJ·mol-1
ΔH=+8.0kJ·mol-1 ΔH=+90.4kJ·mol-1
ΔH=+90.4kJ·mol-1 ΔH=-556.0kJ·mol-1
ΔH=-556.0kJ·mol-1 ΔH=-483.6kJ·mol-1
ΔH=-483.6kJ·mol-1 与
与 反应生成
反应生成 热化学方程式 。
热化学方程式 。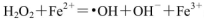
 ,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
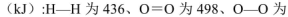
 .
. xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白: 2C
2C CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,