题目内容
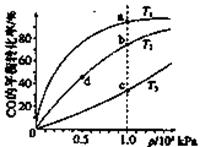
已知反应2H2(g)+CO(g)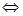 CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列大小比较正确的是
A. 平横常数:K(a)>K(c),K(b)=K(d)
B. 正反应速率:v(a)>v(c),v(b)=v(d)
C. 达到平衡所需时间:t(a)=t(c),t(b)>t(d)
D. 平均相对分子质量:M(a)=M(c),M(b)>M(d)
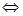 CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列大小比较正确的是
| 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |
| K | 2.50 | 0.34 | 0.15 |

A. 平横常数:K(a)>K(c),K(b)=K(d)
B. 正反应速率:v(a)>v(c),v(b)=v(d)
C. 达到平衡所需时间:t(a)=t(c),t(b)>t(d)
D. 平均相对分子质量:M(a)=M(c),M(b)>M(d)
A
试题分析:A、温度相同,平衡常数相同,不同温度时,CO的转化率越大,平衡向右移动,平衡常数越大,所以K(a)>K(c),K(b)=K(d),正确;B、根据表中数据,温度越高,平衡常数越小,平衡向左移动,说明正反应为放热反应,所以T1 < T2 < T3,则反应速率v(a)<v(c),b、d点温度相同,b点压强大于d,所以v(b)>v(d),错误;C、因为v(a)<v(c),v(b)>v(d),所以达到平衡所需时间:t(a)>t(c),t(b)<t(d),错误;D、平衡向右移动,气体的物质的量减小,平均相对分子质量增大,所以M(a)>M(c),错误。

练习册系列答案
相关题目
 物质
物质
 ΔH >0
ΔH >0 CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。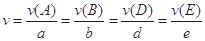 。式中
。式中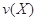 指物质
指物质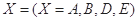 的反应速率,
的反应速率,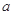 、
、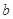 、
、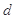 、
、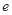 是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表: (H2O2)相等
(H2O2)相等 H=-1266.8kJ·mol-1
H=-1266.8kJ·mol-1
 2SO3(g)体系中,n(SO2)随时间的变化如下表:
2SO3(g)体系中,n(SO2)随时间的变化如下表: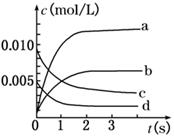
 Si3N4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题: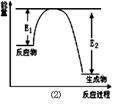

 (正)
(正) 
 Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表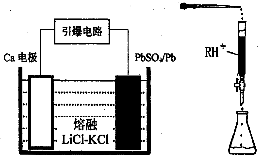
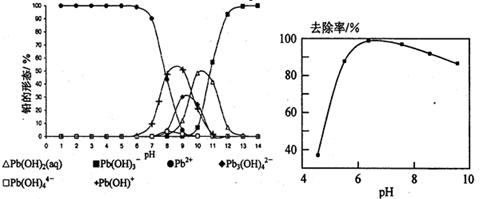

 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是