题目内容
【题目】图为元素周期表的一部分,请根据元素①﹣⑧在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是 (用化学式表示,下同);碱性最强的是 .
(2)④、⑤、⑥的简单离子半径由大到小的顺序是(用离子符号
(3)由①、④、⑤、三种元素组成的化合物中化学键的类型有: .
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族);
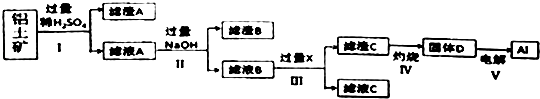
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
A ![]() B
B ![]() C
C
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行.B的化学式为 .
对应的反应①的离子方程式为 .
【答案】
(1)H2SO4、HNO3;NaOH
(2)O2﹣>Na+>Al3+
(3)离子键、共价键
(4)2Mg+CO2 ![]() C+2MgO、Mg+H2SO4=MgSO4+H2↑
C+2MgO、Mg+H2SO4=MgSO4+H2↑
(5)Al(OH)3;Al3++3OH﹣=Al(OH)3↓或【Al(OH)4】﹣+H+=Al(OH)3↓+H2O
【解析】解:(1)由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是S,(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是H2SO4、HNO3;碱性最强的是NaOH,所以答案是:H2SO4、HNO3;NaOH;
(2.)电子层相同的离子,核电荷数越大半径越小,则离子半径为O2﹣>Na+>Al3+ , 所以答案是:O2﹣>Na+>Al3+;
(3.)由①、④、⑤、三种元素H、O、Na形成的化合物是氢氧化钠,它是离子化合物,存在离子键和极性共价键,所以答案是:离子键、共价键;
(4.)符合同一反应中两种单质对应元素既不同周期也不同主族的置换反应,如Mg置换C、Mg置换H,反应分别为2Mg+CO2 ![]() C+2MgO、Mg+H2SO4=MgSO4+H2↑,所以答案是:2Mg+CO2
C+2MgO、Mg+H2SO4=MgSO4+H2↑,所以答案是:2Mg+CO2 ![]() C+2MgO、Mg+H2SO4=MgSO4+H2↑;
C+2MgO、Mg+H2SO4=MgSO4+H2↑;
(5.)A、B、C含同一金属元素,X为强电解质,由图中连续反应可知,若A为铝盐,X为NaOH;若A为偏铝酸盐,X为强酸(如H2SO4或HNO3)则B均为Al(OH)3 ,
对应的反应①的离子方程式为:Al3++3OH﹣=Al(OH)3↓或【Al(OH)4】﹣+H+=Al(OH)3↓+H2O,
所以答案是:Al(OH)3;Al3++3OH﹣=Al(OH)3↓或【Al(OH)4】﹣+H+=Al(OH)3↓+H2O.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案