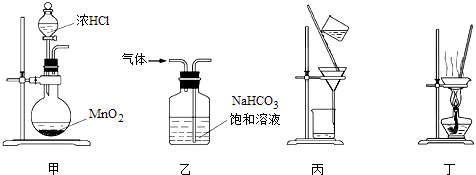
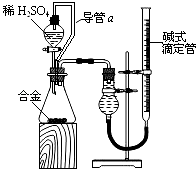
题目内容
【题目】工业上用铝土矿(主要成分为主要成份是Al2O3 , 还含有SiO2和Fe2O3)提取氧化铝并冶炼Al的操作过程如下: 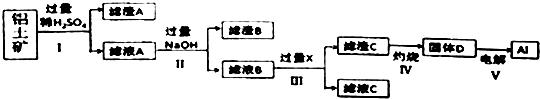
(1)滤渣A是 , 滤渣B是 .
(2)过程 I、II、III的分离操作的名称是 .
(3)过程 IV中灼烧时盛放药品的仪器名称是 , 发生反应的化学方程式是 .
(4)过程 III中发生反应生成滤渣C的离子方程式表示为 .
(5)取滤液B100mL,加入1molL﹣1盐酸200mL时,沉淀量达到最大且质量为11.7g.则溶液B中c(AlO2﹣)= , c(Na+)>molL﹣1 .
【答案】
(1)SiO2(或二氧化硅);Fe(OH)3(或氢氧化铁)
(2)过滤
(3)坩埚;2Al(OH)3 ![]() Al2O3+3H2O
Al2O3+3H2O
(4)AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣
(5)1.5mol?L﹣1;6.5
【解析】解:铝土矿中加入稀硫酸,沉淀A为SiO2 , 滤液A中含有硫酸铝、硫酸铁,加入过量NaOH,沉淀B为Fe(OH)3 , 滤液B中含有NaAlO2 , 通入二氧化碳气体,滤液C中含有碳酸钠或碳酸氢钠,滤渣C为Al(OH)3 , Al(OH)3在加热分解可生成D为Al2O3 , 电解Al2O3生成铝,
(1.)SiO2和稀硫酸不反应,则滤渣A是SiO2(或二氧化硅),滤液A中含有硫酸铝、硫酸铁,加入过量NaOH,沉淀B为Fe(OH)3 ,
所以答案是:SiO2(或二氧化硅);Fe(OH)3(或氢氧化铁);
(2.)过程 I、II、III分离溶液和沉淀,应为过滤操作,所以答案是:过滤;
(3.)过程 IV用于灼烧固体氢氧化铝,应在坩埚中进行,发生反应为2Al(OH)3 ![]() Al2O3+3H2O,
Al2O3+3H2O,
所以答案是:坩埚;2Al(OH)3 ![]() Al2O3+3H2O;
Al2O3+3H2O;
(4.)滤液B的成分是偏铝酸钠,向其中通入过量的二氧化碳,反应为:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣ , 所以答案是:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣;
(5.)根据以上分析滤液B中含有硫酸钠、偏铝酸钠、过量的氢氧化钠,向滤液中加入1mol/L盐酸200mL,沉淀量达到最大且质量为11.7g为Al(OH)3的质量,则根据铝原子守恒,c(AlO2﹣)= ![]() =
= ![]() =1.5molL﹣1 ,
=1.5molL﹣1 ,
最后所得的溶液中溶质为硫酸钠、氯化钠,根据钠离子守恒有n(NaOH)=n(NaCl)+2(Na2SO4),根据氯离子与硫酸根守恒有n(NaCl)=n(HCl)=0.2L×1mol/L=0.2mol,n(Na2SO4)=n(H2SO4)> ![]() n(Al2(SO4)3)=
n(Al2(SO4)3)= ![]() ×
× ![]() mol=0.225mol,故n(NaOH)=n(NaCl)+2(Na2SO4)>0.2mol+2×0.225mol=0.65mol,故c(Na+)>
mol=0.225mol,故n(NaOH)=n(NaCl)+2(Na2SO4)>0.2mol+2×0.225mol=0.65mol,故c(Na+)> ![]() =6.5mol/L,
=6.5mol/L,
所以答案是:1.5molL﹣1;6.5.

【题目】图为元素周期表的一部分,请根据元素①﹣⑧在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是 (用化学式表示,下同);碱性最强的是 .
(2)④、⑤、⑥的简单离子半径由大到小的顺序是(用离子符号
(3)由①、④、⑤、三种元素组成的化合物中化学键的类型有: .
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族);
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
A ![]() B
B ![]() C
C
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行.B的化学式为 .
对应的反应①的离子方程式为 .