��Ŀ����
����Ŀ����100 mL NaOH��Һ��ͨ��һ������CO2���壬��ַ�Ӧ������������Һ����μ���0.2 mol��L��1�����ᣬ����CO2������������������֮���ϵ��ͼ��ʾ��
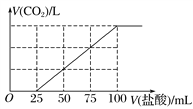
�����ж���ȷ���ǣ� ��
A. ͨ��CO2�ڱ�״���µ����Ϊ448 mL
B. ԭNaOH��Һ��Ũ��Ϊ0.2 mol��L��1
C. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaOH)��n(Na2CO3)��1��3
D. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaHCO3)��n(Na2CO3)��1��1
���𰸡�B
����������0��25mLû���������ɣ���25mL��ʼ���������ɶ�����̼���壬����������100mL��25mL=75mL�������������ĵ���������Ϊ1��3����NaOH��Һͨ��һ����CO2��Ӧ����Һ�е��������ʵ����Ĺ�ϵ��Na2CO3��NaHCO3=1��2��D����C������HCl��NaCl��NaOH����NaOH�����ʵ���Ϊ0.1L��0.2mol/L=0.02mol��Na+�����ʵ���Ũ��Ϊ0.02/0.1=0.2mol/L����B��ȷ����Na2CO3��NaHCO3=1��2����̼ԭ���غ��֪������̼�����ʵ���Ϊ0.075 mL��0.2 mol/L =0.015mol������������������CO2��������ڱ�״����Ϊ0.015mol��22.4L/mol=336mL��A����

 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д� ��ѧ�����ϵ�д�
��ѧ�����ϵ�д�����Ŀ��ͼΪԪ�����ڱ���һ���֣������Ԫ�آ٩����ڱ��е�λ�ã��û�ѧ����ش��������⣺
�� | IA | 0 | ||||||
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | ||||
��1��������Ԫ�ص�����������Ӧ��ˮ�����У�����ǿ����� ���û�ѧʽ��ʾ����ͬ����������ǿ���� ��
��2���ܡ��ݡ��ļ����Ӱ뾶�ɴ�С��˳�����������ӷ���
��3���ɢ١��ܡ��ݡ�����Ԫ����ɵĻ������л�ѧ���������У� ��
��4����д���漰�����й�Ԫ�ص������û���Ӧ��Ҫ��ͬһ��Ӧ�����ֵ��ʶ�ӦԪ�ؼȲ�ͬ����Ҳ��ͬ���壩��
��5���ɱ���Ԫ���γɵij�����������A��B��C��X������ת����ϵ��
A ![]() B
B ![]() C
C
��A��B��C��ͬһ����Ԫ�أ�XΪǿ����ʣ��ҷ�Ӧ������Һ�н��У�B�Ļ�ѧʽΪ ��
��Ӧ�ķ�Ӧ�ٵ����ӷ���ʽΪ ��