题目内容
4.下列除杂方法或试剂正确的是(括号里的是杂质)( )| A. | 溴苯(溴) 加氢氧化钠再分液 | B. | 乙酸(乙醇)用蒸馏 | ||
| C. | 乙酸乙酯(乙酸)直接分液 | D. | 乙烷(乙烯)用酸性高锰酸钾溶液 |
分析 A.溴与氢氧化钠溶液反应;
B.乙酸、乙醇沸点不同,可蒸馏;
C.乙酸乙酯与乙酸混溶;
D.乙烯可被酸性高锰酸钾氧化生成二氧化碳气体.
解答 解:A.溴与氢氧化钠溶液反应,溴苯不溶于水,可分液分离,故A正确;
B.乙酸、乙醇沸点不同,可蒸馏,故B正确;
C.乙酸乙酯与乙酸混溶,应用蒸馏的方法分离,故C错误;
D.乙烯可被酸性高锰酸钾氧化生成二氧化碳气体,应用溴水除杂,故D错误.
故选AB.
点评 本题考查物质的分离、提纯和除杂等问题,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目
15.已知1mol X2完全燃烧生成X2O(g)放出热量a kJ,且氧气中1mol O═O键完全断裂时吸收能量b kJ,X2O中1mol X-O键形成时放出能量c kJ,X2中1mol X-X键断裂时吸收能量为( )
| A. | (4c-b+2c)kJ | B. | $\frac{4c-b-2a}{2}$ kJ | C. | 4c+b-2a kJ | D. | $\frac{4c+b-2a}{2}$ kJ |
12.若用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1 mol Fe与少量氯气反应时转移的电子数为2NA | |
| B. | 0.2 mol S在空气中充分燃烧,转移电子数为0.6NA | |
| C. | 0.1molCl2溶于水中发生反应,转移电子数为0.1NA | |
| D. | 1.5 mol Na2O2与足量的二氧化碳充分反应,转移电子数为1.5NA |
9.根据转化关系判断下列说法正确的是( )


| A. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 | |
| B. | 反应②中,1mol葡萄糖可生成3mol乙醇 | |
| C. | 将在空气中灼绕后的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 反应①中,(C6H10O5)n可表示淀粉或纤维素 |
16.下列说法正确的是( )
| A. | 控制塑料购物袋的使用主要是为了节约成本 | |
| B. | 使用可降解塑料袋有利于减少“白色污染” | |
| C. | 聚氯乙烯塑料袋可用来长时间存放食品 | |
| D. | 塑料购物袋具有热固性,不能回收利用 |
14.体积为V mL,密度为ρ g/mL的含有相对分子质量为M的某物质的溶液,其中溶质为m g,其物质的量浓度为c mol/L,溶质的质量分数为w%,则下列表示正确的是( )
| A. | c=$\frac{1000wρ}{M}$ | B. | m=$\frac{Vρw}{100}$ | C. | w=$\frac{cM}{1000ρ}$% | D. | c=$\frac{m}{VM}$ |
 苹果酸是一种常见的有机酸,其结构简式如图所示:
苹果酸是一种常见的有机酸,其结构简式如图所示: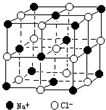 (1)熔点沸点HF>HI;原因:HF分子间含有氢键
(1)熔点沸点HF>HI;原因:HF分子间含有氢键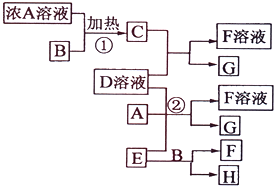 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.