题目内容
15.已知1mol X2完全燃烧生成X2O(g)放出热量a kJ,且氧气中1mol O═O键完全断裂时吸收能量b kJ,X2O中1mol X-O键形成时放出能量c kJ,X2中1mol X-X键断裂时吸收能量为( )| A. | (4c-b+2c)kJ | B. | $\frac{4c-b-2a}{2}$ kJ | C. | 4c+b-2a kJ | D. | $\frac{4c+b-2a}{2}$ kJ |
分析 化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量.
解答 解:1mol X2完全燃烧生成X2O(g)放出热量a kJ,所以化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,设X2中1mol X-X键断裂时吸收能量为K,根据方程式:2X2+O2$\frac{\underline{\;点燃\;}}{\;}$2X2O,则:2akJ=ckJ×4-(2K+bkJ),解得K=$\frac{4c-b-2a}{2}$KJ.
故选B.
点评 本题考查学生化学反应中的能量变化知识,熟记教材知识是解题的关键,可以根据所学知识进行回答,难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
18.利用下列有关实验装置进行相应的实验,能达到实验目的是( )
| A. |  用装置吸收二氧化硫气体 | |
| B. |  用装置除去氯气中的氯化氢杂质 | |
| C. |  用装置可以对硫化氢气体进行尾气处理 | |
| D. |  用装置制备并收集氧气 |
19.以下实验不能获得成功的是( )
| A. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| B. | 提取溶解在水中的少量碘时加入CCl4,分液,取出有机层再分离 | |
| C. | 用适量苯和液溴混合制溴苯时,只需加铁屑,不必加热 | |
| D. | 除去溴苯中的少量Br2时加入KI溶液,充分反应后,弃去水溶液 |
20.据外电报道,中国自行研制的第四代隐身战机也已经进入了试飞阶段,由于我国航空工业基础薄弱,如此神速的研制速度让西方先进国家感到非常吃惊.高科技飞机的生产离不开先进材料,你认为下列材料不宜在飞机上使用的是( )
| A. | 机身隔框一般采用超硬铝,承受较大载荷的加强框采用高强度结构钢或钛合金 | |
| B. | 航空发动机对材料的要求非常高,所以其气缸必须使用纯度相当高的金属材料 | |
| C. | 很多飞机的机载雷达装在机身头部,一般采用玻璃纤维增强塑料做成的头锥将机身头部罩住以便能透过电磁波 | |
| D. | 采用特殊的新型复合材料作为表面涂层,使其几乎不反射雷达所发出的电磁波,雷达就检测不到 |
7.下列化合物分子中的所有原子都处于同一平面的是( )
| A. | 间溴甲苯 | B. | 对二甲苯 | C. | 氯乙烯 | D. | 丙烯 |
4.下列除杂方法或试剂正确的是(括号里的是杂质)( )
| A. | 溴苯(溴) 加氢氧化钠再分液 | B. | 乙酸(乙醇)用蒸馏 | ||
| C. | 乙酸乙酯(乙酸)直接分液 | D. | 乙烷(乙烯)用酸性高锰酸钾溶液 |
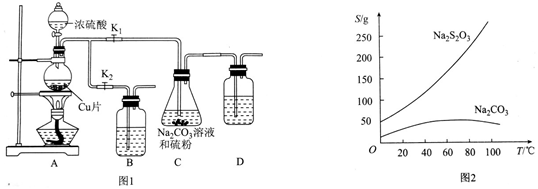
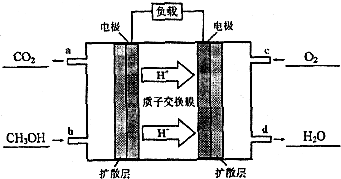 (1)在室温下测得0.1mol•L-1氨水PH=11,则该温度下氨水的电离度α=1.0%
(1)在室温下测得0.1mol•L-1氨水PH=11,则该温度下氨水的电离度α=1.0%