题目内容
反应4NH3+5O2=4NO+6H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率表达正确的是
| A.v(O2)=0.01mol·L-1·s-1 | B.v(NO)="0.008" mol·L-1·s-1 |
| C.v(H2O)="0.003" mol·L-1·s-1 | D.v(NH3)="0.004" mol·L-1·s-1 |
C
解析试题分析:30s内NO的浓度增加0.06mol/L,则v(NO)=" 0.06mol/L/30s=0.002" mol·L-1·s-1 =v(NH3),根据反应速率与化学计量数的关系,v(H2O)="0.003" mol·L-1·s-1 ,答案选C。
考点:考查反应速率的计算,反应速率与化学计量数关系的应用

下列事实不能用勒夏特列原理解释的是
①氯化铁溶液加热蒸干最终得不到氯化铁固体 ②铁在潮湿的空气中容易生锈
③实验室可用排饱和食盐水的方法收集氯气
④常温下,将1 mL pH=3的醋酸加水稀释至100 mL,测得其pH<5
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)  K(g)+NaCl(l)
K(g)+NaCl(l)
⑥二氧化氮与四氧化二氮的平衡体系,加压后颜色加深
| A.②⑥ | B.①②③ | C.②⑤⑥ | D.①③④⑤ |
在C(s)+CO2(g)===2CO(g)的反应中,现采取下列措施:
①缩小体积,增大压强 ②增加碳的量 ③通入CO2 ④恒容下充入N2
⑤恒压下充入N2能够使反应速率增大的措施是( )
| A.①④ | B.②③⑤ | C.①③ | D.①②④ |
一定条件下,水蒸气含量随反应时间的变化趋势符合下图的是( )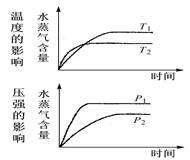
A.CO2(g)+2NH3( g) CO(NH2)2(s)+H2O(g); △H<0 CO(NH2)2(s)+H2O(g); △H<0 |
B.CO2(g)+ H2(g)  CO(g)+H2O(g); △H>0 CO(g)+H2O(g); △H>0 |
C.CH3CH2OH CH2=CH2(g)+ H2O(g); △H>0 CH2=CH2(g)+ H2O(g); △H>0 |
D.2C6H5CH2CH3(g)+O2(g) 2C6H-5CH=CH2(g)+2H2O(g); △H<0 2C6H-5CH=CH2(g)+2H2O(g); △H<0 |
下列措施对增大反应速率明显有效的是( )
| A.Na与水反应时增大水的用量 |
| B.Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
| C.在H2SO4与Na2CO3两溶液反应时,增大压强 |
D.反应N2+3H2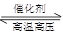 2NH3恒容增加氮气 2NH3恒容增加氮气 |
磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示。
下列说法不正确的是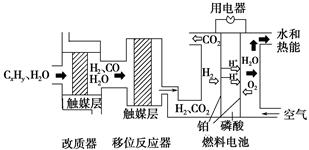
| A.该系统中只存在化学能和电能的相互转化 |
B.在移位反应器中,反应CO(g)+H2O(g) 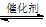 CO2(g)+H2(g)(ΔH>0),若温度越高,则v(CO)越大 CO2(g)+H2(g)(ΔH>0),若温度越高,则v(CO)越大 |
| C.改质器和移位反应器的作用是将CxHy转化为H2和CO2 |
| D.该电池正极的电极反应为O2+4H++4e-=2H2O |
已知298 K时,合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
| A.一定小于92.0 kJ | B.一定大于92.0 kJ |
| C.一定等于92.0 kJ | D.无法确定 |
1000℃时,FeO(s) + H2 Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
| A.1.0 | B.2.0 | C.3.0 | D.4.0 |