题目内容
【题目】(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:___。
(2)微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。请回答下列问题。
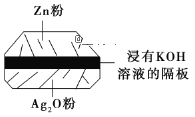
①该电池属于___电池(填“一次”或“二次”)。
②负极材料是___,电极反应式是___。
③使用时,正极区的pH__(填“增大”“减小”或“不变”,下同),电解质溶液的pH___。
【答案】CO(g)+FeO(s)=Fe(s)+CO2(g) ΔH=-218.0kJ·mol-1 一次 Zn Zn+2OH--2e-=ZnO+H2O 增大 不变
【解析】
(1)根据盖斯进行分析计算;
(2)银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O═ZnO+2Ag,该原电池中,Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以Zn是负极失电子发生氧化反应,Ag2O是正极得电子发生还原反应;负极电极反应式为:Zn+2OH--2e-=ZnO+H2O、正极电极反应式为:Ag2O+H2O+2e-=2Ag+2OH-,据此回答。
(1)由①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
结合盖斯定律可知,(①×3-②-③×2)×![]() 得到CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol,
得到CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol,
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol;
(2)①银锌电池属于一次电池,故答案为:一次;
②该原电池中,Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以Zn是负极失电子发生氧化反应,负极电极反应式为:Zn+2OH--2e-=ZnO+H2O,故答案为:Zn;Zn+2OH--2e-=ZnO+H2O;
③正极电极反应式为:Ag2O+H2O+2e-=2Ag+2OH-生成氢氧根离子,所以pH增大,总反应是Zn+Ag2O═ZnO+2Ag,电解质溶液的pH不变,故答案为:增大;不变。