题目内容
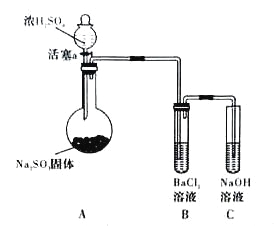
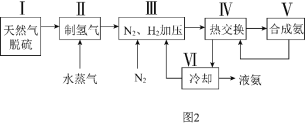
【题目】化学学习小组模拟侯德榜制碱法制取Na2CO3的过程如下:

已知:①反应Ⅰ的化学方程式为:NH3+H2O+CO2=NH4HCO3
②滤液含NH4Cl等溶质
⑴反应Ⅱ为复分解反应,写出该反应的化学方程式______。
⑵验证滤液中含Cl-离子的实验方法和现象为______。
⑶反应Ⅲ的化学方程式为______。
【答案】NH4HCO3+CO2=NaHCO3↓+NH4Cl 用试管取滤液少许,加稀硝酸酸化,滴加AgNO3溶液,若有白色沉淀生成,则滤液中含Cl-离子 2NaHCO3![]() NaHCO3+CO2↑+H2O
NaHCO3+CO2↑+H2O
【解析】
NaCl、CO2、NH3、H2O发生反应生成NaHCO3和NH4Cl;受热条件下,碳酸氢钠分解生成碳酸钠、二氧化碳和水;Cl-的检验常用硝酸酸化的硝酸银溶液,生成不溶于稀硝酸的AgCl沉淀。
(1)CO2、NH3和H2O反应生成NH4HCO3,因为NaHCO3溶解度较小,所以NaCl和NH4HCO3反应生成NaHCO3和NH4Cl,即NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl,故答案为:NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl;
(2)Cl-的检验常用硝酸酸化的硝酸银溶液,方法为:用试管取滤液少许,加稀硝酸酸化,滴加AgNO3溶液,若有白色沉淀生成,则滤液中含Cl-离子;故答案为:用试管取滤液少许,加稀硝酸酸化,滴加AgNO3溶液,若有白色沉淀生成,则滤液中含Cl-离子;
(3)NaHCO3对热不稳定,受热易分解生成Na2CO3、H2O、CO2,化学方程式为2NaHCO3![]() NaHCO3+CO2↑+H2O,故答案为:2NaHCO3
NaHCO3+CO2↑+H2O,故答案为:2NaHCO3![]() NaHCO3+CO2↑+H2O。
NaHCO3+CO2↑+H2O。

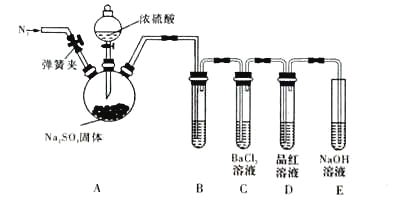
【题目】资料显示“![]() 的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究
的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究![]() 与KI溶液发生反应的条件。
与KI溶液发生反应的条件。

供选试剂:![]() 溶液、
溶液、![]() 固体、
固体、![]() 固体。
固体。
该小组同学设计![]() 、
、![]() 两组实验,记录如下:
两组实验,记录如下:
| 实验操作 | 实验现象 |
| 向Ⅰ试管中加入 | Ⅱ试管中有气泡冒出,溶液不变蓝 |
| 向Ⅰ试管中加入 Ⅱ试管中加入适量 | Ⅱ试管中有气泡冒出,溶液变蓝 |
(1)选择Ⅰ装置用![]() 固体制取
固体制取![]() ,为避免
,为避免![]() 固体随
固体随![]() 进入Ⅱ试管对实验造成干扰,应进行的改进是________,
进入Ⅱ试管对实验造成干扰,应进行的改进是________,![]() 组实验中
组实验中![]() 与KI溶液反应的离子方程式是________。
与KI溶液反应的离子方程式是________。
(2)对比![]() 、
、![]() 两组实验可知,
两组实验可知,![]() 与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(3)为进一步探究碱性条件下KI与![]() 能否反应,用上图中的装置继续进行实验:
能否反应,用上图中的装置继续进行实验:
| 实验操作 | 实验现象 |
| 向Ⅰ试管中加入 | 溶液略变蓝 |
| 向Ⅰ试管中加入 | 无明显变化 |
对于实验![]() 的现象,小明同学提出猜想“
的现象,小明同学提出猜想“![]() 时
时![]() 不能氧化
不能氧化![]() ”,设计了下列装置进行实验,验证猜想。
”,设计了下列装置进行实验,验证猜想。
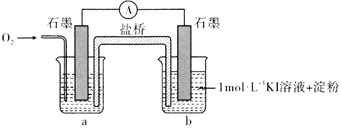
(i)烧杯a中的溶液为________。
(ii)实验结果表明,此猜想不成立。支持该结论的实验现象是通入![]() 后________。
后________。
(iii)小刚同学向![]() 的KOH溶液
的KOH溶液![]() 含淀粉
含淀粉![]() 中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有
中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有![]() ,褪色的原因是________
,褪色的原因是________![]() 用离子方程式表示
用离子方程式表示![]() 。
。
(4)该小组同学对实验过程进行了反思:实验![]() 的现象产生的原因可能是________。
的现象产生的原因可能是________。