题目内容
【题目】已知X、Y、Z、W、K、L六种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y原子核外电子有6种不同的运动状态;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K的+1价阳离子的核外有3层电子且各层均处于全满状态;L位于ds区,它的基态原子的N层上只有2个电子。
请回答下列问题:(答题时,X、Y、Z、W、K、L用所对应的元素符号表示)
(1)ZX5为离子化合物,写出它的电子式_________________。
(2) K的基态原子的电子排布式是______________________。
(3) Y、Z、W元素的第一电离能由大到小的顺序是__________________。
(4)第一电离能I1(L)__I1(K)(填“大于”或“小于”),原因是________________
(5)Y2X4是石油炼制的重要产物之一, 1mol Y2X4分子中含σ键为______mol;
(6)肼(Z2H4)可用作火箭燃料,其原理是:Z2O4(l)+2Z2H4(l)=3Z2(g)+4H2O(g),若反应中有4mol Z-H键断裂,则形成的π键有_________mol.
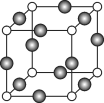
(7)Z、K两元素形成的某化合物的晶胞结构如图所示,则Z原子的配位数是______。
【答案】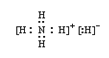 [Ar]3d104s1 N>O>C 大于 Zn核外电子排布式为[Ar]3d104s2 ,Cu核外电子排布式为[Ar]3d104s1。Zn核外电子排布为全满稳定结构,较难失电子 5 3 6
[Ar]3d104s1 N>O>C 大于 Zn核外电子排布式为[Ar]3d104s2 ,Cu核外电子排布式为[Ar]3d104s1。Zn核外电子排布为全满稳定结构,较难失电子 5 3 6
【解析】
X、Y、Z、W、K、L六种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素,则X为H元素;Y原子核外电子有6种不同的运动状态,则Y为碳元素;W位于第2周期,其原子核外成对电子数是未成对电子数的3倍,原子核外电子排布为1s22s22p4,则W为O元素;Z的原子序数介于碳、氧之间,故Z为N元素;K的+1价阳离子的核外有3层电子且各层均处于全满状态,则K为Cu;L位于ds区,它的基态原子的N层上只有2个电子,则L为Zn,据此解答。
X、Y、Z、W、K、L六种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素,则X为H元素;Y原子核外电子有6种不同的运动状态,则Y为碳元素;W位于第2周期,其原子核外成对电子数是未成对电子数的3倍,原子核外电子排布为1s22s22p4,则W为O元素;Z的原子序数介于碳、氧之间,故Z为N元素;K的+1价阳离子的核外有3层电子且各层均处于全满状态,则K为Cu;L位于ds区,它的基态原子的N层上只有2个电子,则L为Zn,
(1)NH4H为离子化合物,电子式为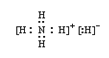 ,
,
因此,本题正确答案是: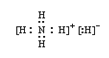 ;
;
(2) K为Cu元素,基态原子的电子排布式是:[Ar]3d104s1,
因此,本题正确答案是:[Ar]3d104s1;
(3) 同周期随原子序数增大,元素第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
因此,本题正确答案是:N>O>C;
(4) Zn核外电子排布式为[Ar]3d104s2 ,Cu核外电子排布式为[Ar]3d104s1,Zn核外电子排布为全满稳定结构,较难失电子,所以第一电离能I1(Zn)大于I1(Cu),
因此,本题正确答案是:大于;Zn核外电子排布式为[Ar]3d104s2 ,Cu核外电子排布式为[Ar]3d104s1。Zn核外电子排布为全满稳定结构,较难失电子;
(5)单键为σ键,双键中含1个σ键和1个π键,一个C2H4分子中含有一个碳碳双键和4个碳氢单键,则1mol C2H4分子中含σ键为5 mol,
因此,本题正确答案是:5;
(6) 由反应式N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)可知,若反应中有4mol Z-H键断裂,则反应了1mol N2H4,生成了1.5mol N2,一个N2中有2个π键,则形成的π键有1.5mol×2=3mol,
因此,本题正确答案是:3;
(7) Z为N元素,K为Cu元素,晶胞中白球有8×![]() =1个,黑球有12×
=1个,黑球有12×![]() =3个,则白球为N,黑球为Cu,根据晶胞,Cu原子的配位数为2,N原子配位数为
=3个,则白球为N,黑球为Cu,根据晶胞,Cu原子的配位数为2,N原子配位数为![]() =6,
=6,
因此,本题正确答案是:6。