题目内容
【题目】黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义。
(1)工业上煅烧黄铁矿可制取SO2。已知下列热化学方程式
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=akJ/mol
S(s)+O2(g)=SO2(g) △H=bkJ/mol
Fe(s)+2S(s)=FeS2(s) △H=ckJ/mol
则4Fe(s)+3O2(g)=2Fe2O3(s) △H=_____kJ/mol
(2)一种酸性条件下催化氧化黄铁矿的物质转化关系如图I所示。
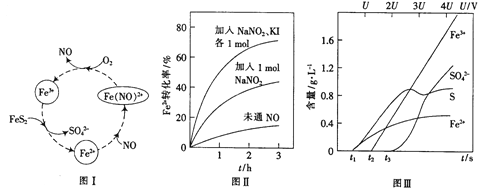
(1)写出如图中Fe3+与FeS2反应的离子方程式:______________。
(2)硝酸也可将FeS2氧化为Fe3+和SO42-,使用浓硝酸比使用稀硝酸反应速率慢,其原因是______________。
(3)控制Fe2+的浓度、溶液体积和通入O2的速率一定,图II所示为改变其他条件时Fe2+被氧化的转化率随时间的变化。
① 加入NaNO2发生反应:2H++3NO2-=NO3-+2NO+H2O。若1mol NaNO2完全反应则转移电子的数目为______mol。
② 加入NaNO2、KI发生反应:4H++2NO2-+2I-=2NO+I2+2H2O。解释图II中该条件下能进一步提高单位时间内Fe2+转化率的原因:______________。
(4)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生粒子的含量与时间、电压(U)的关系如图III所示。
①写出t1至t2间FeS2所发生的电极反应式:__________。
②当电压的值介于3U~4U之间,FeS2放电所得主要粒子为___________。
【答案】 a+4c-8b 14Fe3++FeS2+8H2O=15Fe2++2SO42-+16H+ 稀硝酸反应后被还原为NO,浓硝酸被还原为NO2,NO可作催化剂,NO2不能 2/3 生成的催化剂NO更多,加快了反应速率 FeS2-2e-=Fe2++2S Fe3+、SO42-
【解析】(1)①4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=akJ/mol,②S(s)+O2(g)=SO2(g) △H=bkJ/mol,③Fe(s)+2S(s)=FeS2(s) △H=ckJ/mol,将①×1-②×8+③×4,则4Fe(s)+3O2(g)=2Fe2O3(s) △H=(a+4c-8b)kJ/mol;(2)硝酸也可将FeS2氧化为Fe3+和SO42-,使用浓硝酸比使用稀硝酸反应速率慢,其原因是稀硝酸反应后被还原为NO,浓硝酸被还原为NO2,NO可作催化剂,NO2不能。(3)① 加入NaNO2发生反应:2H++3NO2-=NO3-+2NO+H2O。每3molNO2―反应,有1moLNO2―作氧化剂,则有2mol作还原剂,若1mol NaNO2完全反应则转移电子的数目为2/3mol。② 加入NaNO2、KI发生反应:4H++2NO2-+2I-=2NO+I2+2H2O。该条件下能进一步提高单位时间内Fe2+转化率的原因:生成的催化剂NO更多,加快了反应速率;(4)由图① t1至t2间Fe2+和2S的是增加,FeS2所发生的电极反应式:FeS2-2e-=Fe2++2S ,②当电压的值介于3U~4U之间,Fe3+、SO42-浓度增加,FeS2放电所得主要粒子为Fe3+、SO42-。

【题目】实验室欲配制1mol/L NaOH溶液240ml,请回答:
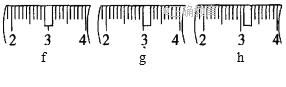
(1)需称取NaOH固体____________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小___________(填字母),并在下图中选出能正确表示游码位置的选项____________(填字母)。
附表砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
(2)选用的主要玻璃仪器除烧杯、玻璃棒外还有_____________________________。
(3)下列操作的顺序是(用序号表示)_________________。
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)下列情况对所配制的NaOH溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①容量瓶用蒸馏洗涤后残留有少量的水________________
②将热的溶液直接移入了容量瓶________________
③定容时,仰视容量瓶的刻度线________________
④转移溶液时,玻璃棒的下端在容量瓶的刻度线以上________________




