题目内容
【题目】Ⅰ.已知亚硝酸钠能发生如下反应:2NaNO2+ 4HI= 2NO + I2 + 2NaI + 2H2O
(1)用双线桥表示电子转移的方向与数目__________。
(2)若有1mol还原剂被氧化,则在此反应中发生转移的电子数目为_________。
II.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
(1)该反应中还原产物为__________。
(2)每生成2molCuI,有__________mol KI被IO3-氧化。
【答案】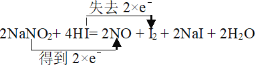 NA I2、CuI 20
NA I2、CuI 20
【解析】
亚硝酸钠中氮的化合价降低,碘化氢中碘的化合价升高,有4 mol HI参与反应,但只有2 molHI被氧化;2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O中,KI中I的化合价升高,Cu(IO3)2中铜、碘化合价降低。
Ⅰ⑴氮元素的化合价由+3价降至+2价,I元素的化合价由-1价升至0价,用双线桥表示电子转移的方向与数目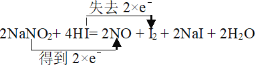 ,故答案为:
,故答案为: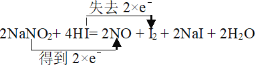 ;
;
⑵根据反应方程式有4 molHI作为反应物,但只有2 molHI作还原剂,转移2 mol电子,因此有1mol还原剂被氧化,则在此反应中发生转移的电子数目为NA,故答案为:NA;
II.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
⑴Cu(IO3)2中的碘的化合价由+5价降低变为单质碘中的0价,铜的化合价由+2价降至碘化亚铜中的+1价,I2、CuI都是还原产物,因此还原产物为I2、CuI,故答案为:I2、CuI;
⑵根据反应方程式得出,每生成2molCuI,有2 mol+2价的铜氧化2 mol I-生成1 mol单质碘,而+2价铜变为+1价铜,有4 molIO3-氧化20 mol I-生成10 mol单质碘,因此每生成2molCuI,有20 mol KI被IO3-氧化,故答案为20。

 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
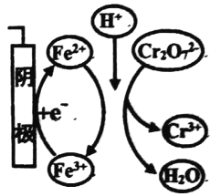
学而优暑期衔接南京大学出版社系列答案【题目】用电解法处理含Cr2072-的废水,探究不同因素对含Cr2072-废水处理的影响,结果如表所示(Cr2072-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(S04)3 | 否 | 否 | 否 | ||
是否加入H2S04 | 否 | 加入lmL | 加入lmL | 加入lmL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2072-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2072-的机理 |
A. 实验ii与实验i对比,其他条件不变,增加c(H+)有利于Cr2072-的去除
B. 实验iii与实验ii对比,其他条件不变,增加c(Fe3+)有利于Cr2072-的去除
C. 实验iv中循环利用提高了Cr2072-的去除率
D. 若实验iv中去除O.OlmolCr2072-电路中共转移0.06mol电子