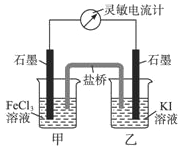
题目内容
【题目】以铜为原料可制备应用广泛的氧化亚铜。
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,发生反应的化学方程式为:____。
(2)由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=___。
CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=___。
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图1所示。溶液中③、④二步总反应的离子方程式为:___。
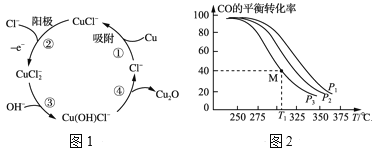
(4)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH=a kJ·mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) ΔH=a kJ·mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
①该反应的ΔH___0(填“<”或“>”),图中压强P1、P2、P3由大到小的关系是___。
②起始时,容器中c(H2)=0.20mol·L-1,c(CO)=0.10mol·L-1,在P3及T1℃下反应达到平衡,此时反应的平衡常数为___。(保留一位小数)
起始时,若容器中c(H2)=0.40mol·L-1,c(CO)=0.20mol·L-1,T1℃下反应达到平衡,CO的平衡转化率____。
A.大于40% B.小于40% C.等于40% D.等于80%
【答案】2CuCl2+SO2+2H2O=2CuCl↓+2HCl+H2SO4 Kw×Ksp(CuCl)/Ksp(CuOH) 2CuCl2-+2OH-===Cu2O↓+H2O+4Cl- < P1>P2>P3 46.3 A
【解析】
(1)氯化铜溶液中通入二氧化硫具有还原性,还原得到白色的CuCl沉淀,二氧化硫被氧化为硫酸;
(2)CuCl(s)+H2O(l)CuOH(s)+Cl-(aq)+H+(aq),平衡常数K=c(H+)![]() c(Cl-),可变形成K=
c(Cl-),可变形成K=![]() ;
;
(2)据图1循环流程分析方程式,反应物是CuCl2和OH-,生成物是Cu2O、Cl-,再根据原子守恒配平;
(3)①根据图示信息,结合方程式判断压强和温度对平衡移动的影响进行解答;
②列出三段式,根据K=![]() 进行计算;起始时,若容器中c(H2)=0.40mol·L-1,c(CO)=0.20mol·L-1,则相当于加压,利用压强对平衡的影响作答。
进行计算;起始时,若容器中c(H2)=0.40mol·L-1,c(CO)=0.20mol·L-1,则相当于加压,利用压强对平衡的影响作答。
(1)氯化铜溶液中通入二氧化硫具有还原性,还原得到白色的CuCl沉淀,二氧化硫被氧化为硫酸,反应的离子方程式为2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-;
(2)CuCl(s)+H2O(l)CuOH(s)+Cl-(aq)+H+(aq),平衡常数K=平衡常数K=c(H+)![]() c(Cl-)=
c(Cl-)=![]() = Kw×Ksp(CuCl)/Ksp(CuOH);
= Kw×Ksp(CuCl)/Ksp(CuOH);
(3)图中③、④二步循环流程分析可知,反应物是CuCl2和OH-,生成物是Cu2O、Cl-和H2O,其离子方程式为:2CuCl2-+2OH-=Cu2O↓+H2O+4Cl-;
(4)①由图可知,压强一定时,升高温度,CO的平衡转化率降低,不利于平衡向正向移动,说明该反应为放热反应,ΔH<0;;温度一定时,CO的转化率α(P3)<α(P2)<α(P1),该正反应是气体物质的量减小的反应,增大压强平衡向正反应进行,CO的转化率升高,故压强P1>P2>P3,
故答案为:<;P1>P2>P3;
②c变(CO)=0.1mol/L×40%=0.04mol/L,
CO(g)+2H2(g)═CH3OH(g)
开始(mol/L) 0.10 0.200
变化(mol/L)0.04 0.08 0.04
结束(mol/L) 0.06 0.12 0.04
化学平衡常数K=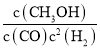 =
=![]() =46.3;
=46.3;
恒容密闭容器内,起始时若容器中c(H2)=0.40mol·L-1,c(CO)=0.20mol·L-1与原体系相比,相当于增大一倍压强,该反应时气体分子数减小的反应,则增大压强平衡会向正反应方向移动,有利于提高CO的平衡转化率,T1

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mo N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
NH3浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
A. 2p1=2p3<p2 B. 达到平衡时丙容器中NH3的体积分数最大
C. α2+α3<1 D. Q1+Q3=92.4