题目内容
3.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,总反应式为:2C2H6+7O2+8KOH═4K2CO3+10H2O,下列推断正确的是( )| A. | 负极反应为7O2+14 H2O+28e-→28OH- | |
| B. | 每消耗1molC2H6,则电路上转移的电子为14mol | |
| C. | 放电一段时间后,负极周围的pH升高 | |
| D. | 放电过程中KOH的物质的量浓度减小 |
分析 由电池总反应2C2H6+7O2+8KOH=4K2CO3+10H2O可知,原电池工作时C2H6被氧化生成K2CO3,应为原电池的负极,电极反应式为C2H6+18OH--14e-=2CO32-+12H2O,O2得电子被还原,应为原电池正极,电极反应式为2H2O+O2+4e-=4OH-,据此分析解答.
解答 解:A.该燃料电池中通入燃料乙烷的电极是负极、通入氧化剂氧气的电极是正极,该燃料电池中负极反应式C2H6+18OH--14e-=2CO32-+12H2O,正极反应式为2H2O+O2+4e-=4OH-,故A错误;
B.根据C2H6+18OH--14e-=2CO32-+12H2O知,每消耗1molC2H6,则电路上转移的电子为14mol,故B正确;
C.负极消耗OH-离子,负极周围的pH值减小,故C错误;
D.电池工作过程中,电池总反应为2C2H6+8OH-+7O2=4CO32-+10H2O,反应消耗OH-离子,所以KOH的物质的量浓度减小,故D正确;
故选BD.
点评 本题考查化学电源新型电池,为高频考点,所有燃料电池中通入燃料的电极是负极、通入氧化剂的电极是正极,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.2013年6月20日10时,宇航员王亚平在天宫一号进行了精彩的“太空授课”,给学生们留下深刻的印象,同时也激发大家对科学的探索.下列说法错误的是( )
| A. | 中国结附着在水膜表面主要受水的表面张力影响 | |
| B. | 太空水球中存在分子间作用力和氢键 | |
| C. | 红色液体均匀的分散在水球中,说明分子是在不断做无规则运动 | |
| D. | 红色液体均匀的分散在水球中属于化学变化 |
14.下列图标中,表示“剧毒品”的是( )
| A. |  | B. |  | C. |  | D. |  |
11.在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
| A. | v(H2)=0.015mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(NH3)=0.17mol/(L•min) | D. | v(NH3)=0.02mol/(L•min) |
18.1molAl分别与足量下列物质反应,所得金属的物质的量最少的是( )
| A. | WO3 | B. | Fe3O4 | C. | MnO2 | D. | Fe2O3 |
8.在容积不变的密闭容器中进行如下反应:H2O(g)+C(s)?H2(g)+CO(g)△H>0 达到平衡后,改变下列反应条件,相关叙述正确的是( )
| A. | 加入H2O(g),平衡向正反应方向移动,体系压强减小 | |
| B. | 加入少量C,正反应速率增大 | |
| C. | 降低温度,平衡向正反应方向移动 | |
| D. | 加入CO,混合气体的密度增大 |
15.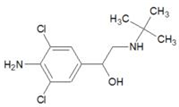 2011年3 月17日《京华时报》报道,双汇集团就“瘦肉精”事件致谦,涉事子公司停产整顿.盐酸克伦特罗(clenbuteerol CLB),俗名“瘦肉精”. 其结构如图所示,下列有关“瘦肉精”的说法中正确的是( )
2011年3 月17日《京华时报》报道,双汇集团就“瘦肉精”事件致谦,涉事子公司停产整顿.盐酸克伦特罗(clenbuteerol CLB),俗名“瘦肉精”. 其结构如图所示,下列有关“瘦肉精”的说法中正确的是( )
 2011年3 月17日《京华时报》报道,双汇集团就“瘦肉精”事件致谦,涉事子公司停产整顿.盐酸克伦特罗(clenbuteerol CLB),俗名“瘦肉精”. 其结构如图所示,下列有关“瘦肉精”的说法中正确的是( )
2011年3 月17日《京华时报》报道,双汇集团就“瘦肉精”事件致谦,涉事子公司停产整顿.盐酸克伦特罗(clenbuteerol CLB),俗名“瘦肉精”. 其结构如图所示,下列有关“瘦肉精”的说法中正确的是( )| A. | 该分子是极性分子 | |
| B. | 该分子中有两个手性碳 | |
| C. | 分子中C、N、O的第一电离能的大小顺序为:C<N<O | |
| D. | 苯环上的一溴代物只有一种结构 |
13.下列四种元素中,其单质的氧化性最强的是( )
| A. | 基态原子含有未成对电子最多的第二周期元素 | |
| B. | 某激发态为1s22s12p3的原子 | |
| C. | 基态原子最外层电子排布为2s22p6的元素 | |
| D. | 基态原子最外层电子排布为3s23p5的元素 |