题目内容
13. 随着经济的发展和生活水平的提高,近年来我省汽车拥有量呈较快增长趋势.
随着经济的发展和生活水平的提高,近年来我省汽车拥有量呈较快增长趋势.(1)金属防护对汽车工业具有重要意义.铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化铝薄膜,该氧化膜不溶于电解时使用的电解液--稀硫酸.写出该过程阳极反应的电极反应式2Al+3H2O-6e-=Al2O3+6H+.
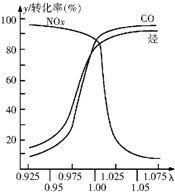
(2)在发动机和三元催化转化器间的尾气流中安装一个称为λ探测器的电化学元件,可测定λ(λ=入口处的空气量/完全燃烧需要的空气量)值,如图所示.当汽车速度增加时,入口处的空气量增大,此时排出尾气中的主要污染物是NOX.在转化器的前半部,一氧化碳和氮氧化物(NOx)通过催化剂发生反应转化为无污染的气体,其反应的化学方程式为2xCO+2NOX催化剂_N2+2xCO2.为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料.已知:甲醇燃烧热为726kJ/mol.请写出甲醇燃烧的热化学方程式2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ/mol.
分析 (1)该氧化膜为致密的氧化铝,则阳极铝失电子与水反应生成氧化铝;
(2)汽车尾气主要污染物是氮氧化物;一氧化碳和氮氧化物(NOx)通过催化剂发生反应转化为无污染的气体氮气和二氧化碳;根据甲醇的燃烧热书写其热化学反应方程式.
解答 解:(1)该氧化膜为致密的氧化铝,则阳极铝失电子与水反应生成氧化铝,电极反应式为:2Al+3H2O-6e-=Al2O3+6H+,故答案为:2Al+3H2O-6e-=Al2O3+6H+;
(2)汽车尾气主要污染物是氮氧化物;一氧化碳和氮氧化物(NOx)通过催化剂发生反应转化为无污染的气体氮气和二氧化碳,反应方程式为2xCO+2NOX催化剂_N2+2xCO2,甲醇燃烧热为726kJ/mol,则2mol甲醇完全燃烧放出1452kJ热量,则其热化学反应方程式为2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ/mol,
故答案为:NOX;2xCO+2NOX催化剂_N2+2xCO2;2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ/mol.
点评 本题考查了氮及其化合物对环境的影响、热化学反应方程式的书写等知识点,侧重考查学生对知识的迁移应用,难度中等.

练习册系列答案
相关题目
3.下列各组离子在溶液中可以大量共存的是( )
| A. | Ag+,K+,NO3-,Cl- | B. | Cu2+,Cl-,NO3-,OH- | ||
| C. | Ca2+,Cl-,CO32-,NO3- | D. | Mg2+,Cl-,SO42-,Na+ |
4.下列离子方程式正确的是( )
| A. | 等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生:Cu 2++2Br- 电解_Cu+Br2 | |
| B. | Na2S溶液水解:S2-+2H2O?H2S+2OH- | |
| C. | Fe(NO3)3的酸性溶液中通入足量硫化氢:2Fe3++H2S=2Fe2++S↓+2H+ | |
| D. | H218O中投入Na2O2:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
1.实验室常用MnO2与浓盐酸反应制备Cl2,制备反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,下列实验方案不可行的是( )
| A. | 采用酸碱中和滴定法测定 | |
| B. | 与足量Zn反应,测量生成的H2体积 | |
| C. | 与足量AgNO3溶液反应,称量生成的AgCl质量 | |
| D. | 与足量CaCO3反应,测量生成的CO2质量 |
8.下列关于合金的说法错误的是( )
| A. | 合金是由两种或两种以上的金属与非金属经一定方法所合成的具有金属特性的物质 | |
| B. | 镁铝合金的熔点比镁和铝都髙 | |
| C. | 在合金中加入适量的稀土金属能大大改善其性能 | |
| D. | 青铜、硬铝、钢都是合金 |
5.氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
关于这两种晶体的说法,正确的是( )
关于这两种晶体的说法,正确的是( )

| A. | 立方相氮化硼含有σ键和π键,所以硬度大 | |
| B. | 六方相氮化硼层间作用力小,所以质地软 | |
| C. | 两种晶体中的既有极性键又有非极性键 | |
| D. | 两种晶体均为原子晶体 |
2.根据下列各反应现象所归纳的元素性质不正确的是( )
| A. | 将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出,不能说明钠的金属性比铜弱 | |
| B. | 用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝,说明氯元素的非金属性比碘元素强 | |
| C. | 把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出,说明Cl的非金属性比S强 | |
| D. | 将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol,说明这三种金属的活泼性为:Al>Mg>Na |
3.下列有关原电池的说法正确的是( )
| A. | 原电池是把电能转化为化学能的装置 | |
| B. | 原电池中电子流出的一极是负极,发生还原反应 | |
| C. | 构成原电池的两极必须是两种不同的金属 | |
| D. | Cu-Fe稀硫酸原电池工作时,铜是正极 |
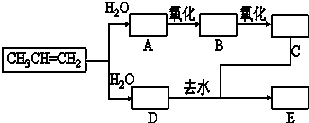 已知:①丙烯与水进行加成反应,其可能的产物有两种;②图中E为开链的酯类化合物,其分子式为C6H12O2.
已知:①丙烯与水进行加成反应,其可能的产物有两种;②图中E为开链的酯类化合物,其分子式为C6H12O2.