题目内容
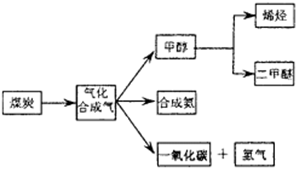
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡常数表达式为:
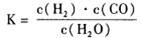
它所对应反应的化学方程式为_______。
已知在一定温度下,在同一平衡体系中各反应及平衡常数如下:
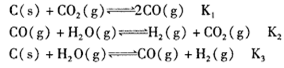
则K1、K2、K3之间的关系为_______。
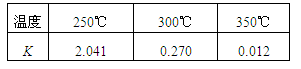
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应: , 该反应平衡常数随温度的变化如下:
, 该反应平衡常数随温度的变化如下:

该反应的逆反应方向是_______反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为_______。
(3)甲醇是一种新型的汽车动力燃料,可通过CO和H2化合制备甲醇,该反应的热化学方程式为: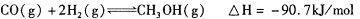
下列描述中能说明上述反应已达平衡的是_______;
A. 容器内气体的平均摩尔质量保持不变
B.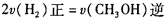
C. 容器中气体的压强保持不变
D. 单位时间内生成n molCO的同时生成2n mol H2
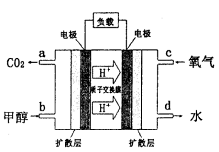
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如下图所示,该燃料电池的电池反应式为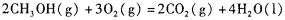 ,则负极的电极反应式为_______。
,则负极的电极反应式为_______。
(5) CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其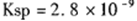 。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与
。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与 的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。
的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。

(1)已知该产业链中某反应的平衡常数表达式为:
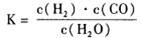
它所对应反应的化学方程式为_______。
已知在一定温度下,在同一平衡体系中各反应及平衡常数如下:
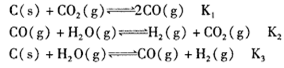
则K1、K2、K3之间的关系为_______。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:
 , 该反应平衡常数随温度的变化如下:
, 该反应平衡常数随温度的变化如下:
该反应的逆反应方向是_______反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为_______。
(3)甲醇是一种新型的汽车动力燃料,可通过CO和H2化合制备甲醇,该反应的热化学方程式为:
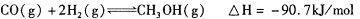
下列描述中能说明上述反应已达平衡的是_______;
A. 容器内气体的平均摩尔质量保持不变
B.
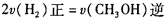
C. 容器中气体的压强保持不变
D. 单位时间内生成n molCO的同时生成2n mol H2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如下图所示,该燃料电池的电池反应式为
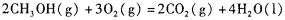 ,则负极的电极反应式为_______。
,则负极的电极反应式为_______。
(5) CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其
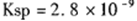 。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与
。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与 的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。
的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。(11分)(1)C(s)+H2O(g) CO(g)+H2(g)(1分); K3=K1?K2(1分);
CO(g)+H2(g)(1分); K3=K1?K2(1分);
(2)吸热(2分); 75% (2分) ; (3)A、C(2分);
(4)CH3OH-6e- +H2O=CO2+6H+ (1分)。
(5)5.6×10—5mo1/L (2分)
 CO(g)+H2(g)(1分); K3=K1?K2(1分);
CO(g)+H2(g)(1分); K3=K1?K2(1分);(2)吸热(2分); 75% (2分) ; (3)A、C(2分);
(4)CH3OH-6e- +H2O=CO2+6H+ (1分)。
(5)5.6×10—5mo1/L (2分)
试题分析:(1)由平衡常数表达式分析得,所对应反应的化学方程式为C(s)+H2O(g)
 CO(g)+H2(g)。在同一平衡体系中,由化学方程式分析得,K3=K1?K2。
CO(g)+H2(g)。在同一平衡体系中,由化学方程式分析得,K3=K1?K2。(2)由表中信息得,温度越大平衡常数越小,说明反应物的浓度逐渐增大,故反应为吸热反应。由化学方程式计算得反应达到平衡时CO的转化率为75%
(3)B项:正、逆反应速率之比不与化学计量数之比相等,故错;
D项:同为逆反应速率,故错。
故选AC。
(4)由化学方程式得,CH3OH是负极,故负极的电极反应式为CH3OH-6e- +H2O=CO2+6H+。
(5)由反应的化学方程式和
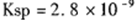 计算得,生成沉淀时原CaCl2溶液的最小浓度为5.6×10—5mo1/L。
计算得,生成沉淀时原CaCl2溶液的最小浓度为5.6×10—5mo1/L。点评:本题考查的是煤的综合利用、化学平衡、燃料电池和溶解平衡的综合知识,题目难度大,考查学生对基础知识的掌握程度和分析问题、解决问题的能力。

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
 zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是( )
zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是( ) 2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是
2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是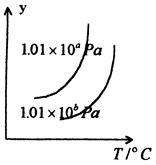
 HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 2NH3(g) ;△H=-92.4kJ/mol。
2NH3(g) ;△H=-92.4kJ/mol。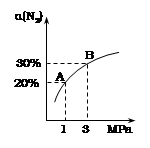
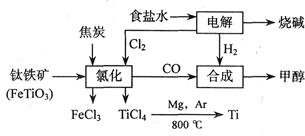
 2MgCl4+Ti在Ar气氛中进行的理由是____________________。
2MgCl4+Ti在Ar气氛中进行的理由是____________________。 CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol
CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol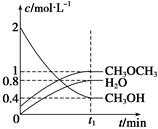
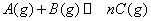
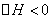 ,在不同条件下反应混合物中C的质量分数C%和反应过程所需时间的关系曲线,有关叙述一定正确的是
,在不同条件下反应混合物中C的质量分数C%和反应过程所需时间的关系曲线,有关叙述一定正确的是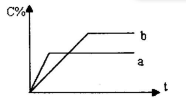
 2SO3(g),△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c-d处。
2SO3(g),△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;若增大压强时,反应速度变化情况画在c-d处。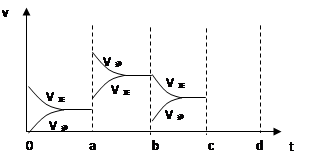
 CH3OH(g) ΔH,在不同温度下的化学平衡常数(K)如表所示。
CH3OH(g) ΔH,在不同温度下的化学平衡常数(K)如表所示。