题目内容
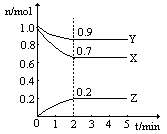
已知: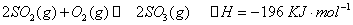 时,在2L固定容积的密闭容器中充入2mol
时,在2L固定容积的密闭容器中充入2mol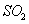 和2mol
和2mol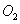 ,10分钟后达到平衡,
,10分钟后达到平衡,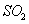 浓度和时间关系如图。
浓度和时间关系如图。
回答下列问题
(1)前5分钟内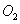 的平均反应速率为
的平均反应速率为
(2)能说明上述反应一定达到平衡的条件是
(3)平衡时,02的转化率为 ,此时反应共 (填“放出”或“吸收”)的热量为 kJ。该温度下的平衡常数K= .
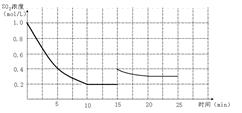
(4)若15分钟时维持温度不变,压缩容器体积,使其体积变为1L,假设在20分钟时达 到新平衡,此时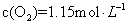 ,请在图上画出15-25分钟
,请在图上画出15-25分钟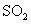 的浓度变化曲线。
的浓度变化曲线。
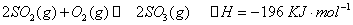 时,在2L固定容积的密闭容器中充入2mol
时,在2L固定容积的密闭容器中充入2mol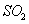 和2mol
和2mol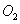 ,10分钟后达到平衡,
,10分钟后达到平衡,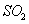 浓度和时间关系如图。
浓度和时间关系如图。回答下列问题
(1)前5分钟内
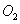 的平均反应速率为
的平均反应速率为 (2)能说明上述反应一定达到平衡的条件是
A.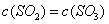 | B.气体总物质的量不变 |
C.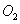 的浓度保持不变 的浓度保持不变 | D.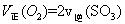 ) ) |
(4)若15分钟时维持温度不变,压缩容器体积,使其体积变为1L,假设在20分钟时达 到新平衡,此时
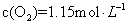 ,请在图上画出15-25分钟
,请在图上画出15-25分钟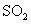 的浓度变化曲线。
的浓度变化曲线。(1)0.06 mol·L-1·min-1 (2分,数值对单位不写扣1分)
(2)BC (2分,漏答给1分,错答不给分)
(3)0.4 放出 156.8 26.7 (每空2分)
(4) (2分)
(2分)
(2)BC (2分,漏答给1分,错答不给分)
(3)0.4 放出 156.8 26.7 (每空2分)
(4)
 (2分)
(2分)试题分析:(1)根据图像可知,前5分钟内SO2的浓度减少了1.0mol/L-0.4mol/L=0.6mol,所以根据方程式可知,氧气的浓度就应该减少0.3mol/L,所以氧气的平均反应速率为0.3mol/L÷5min=0.06mol·L-1·min-1。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项C正确平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以选项A不正确。该反应是体积减小的可逆反应,所以当气体的总的物质的量不再发生变化时,可以说明,B正确。D中反应速率的方向相反,但不能满足速率之比是相应的化学计量数之比,不能说明,因此答案选BC。
(3)平衡时SO2的浓度是0.2mol/L,则消耗SO2的浓度是0.8mol/L,则消耗氧气的浓度是0.4mol/L,生成三氧化硫的浓度是0.8mol/L,所以氧气的转化率是
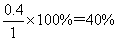 ,此时反应共放出的热量是0.8mol×196kJ/mol=156.8kJ。平衡时氧气的浓度是1mol/L-0.4mol/L=0.6mol/L,所以平衡常数K=
,此时反应共放出的热量是0.8mol×196kJ/mol=156.8kJ。平衡时氧气的浓度是1mol/L-0.4mol/L=0.6mol/L,所以平衡常数K=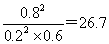 。
。(4)若15分钟时维持温度不变,压缩容器体积,使其体积变为1L,则相当于是增大压强,平衡向正反应方向移动,SO2的浓度先是瞬间变为0.4mol/L,然后慢慢的降低,但平衡时仍然大于0.2mol/L。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难度较大,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在考查灵活运用基础知识解决实际问题的能力。有利于调动学生的学习兴趣和学习积极性,提高学生的应试能力和学科素养。

练习册系列答案
相关题目
 CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如右图所示:
CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如右图所示: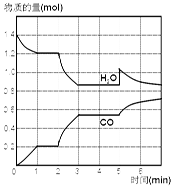
 Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。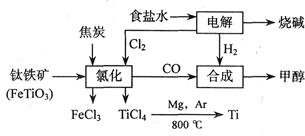
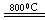 2MgCl4+Ti在Ar气氛中进行的理由是____________________。
2MgCl4+Ti在Ar气氛中进行的理由是____________________。 CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol
CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol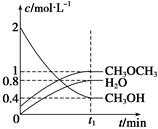
 2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:
2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:

 2NH3已达到平衡状态 ( )
2NH3已达到平衡状态 ( )