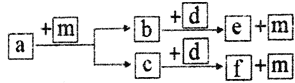
题目内容
【题目】(1)根据杂化轨道理论判断下列分子的空间构型是V形的是_____(填序号)。
a . BeCl2 b . H2O c . HCHO d . CS2
(2)己知AlCl3的沸点:1 90 ℃ (2.5个大气压),但是它在178 ℃ 就开始升华,则AlCl3的晶体类型为_______;为什么工业上一般不采用电解熔融氯化铝的方法制备金属铝________。 (3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T 比Q 多2。T的基态原子外围电子(价电子)排布式为__________, Q2+的未成对电子数是______。
(4)下图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图象是下图中的_______(填序号)。

(5)[Cu(NH3)4]2+配离子中存在的化学键类型有_______(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
已知:[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3 被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________。
(6)X与Y可形成离子化合物,其晶胞结构如图所示,其中X和Y的相对原子质量分别为a 和b,晶体密度为pg · cm-3,则晶胞中距离最近的X、Y之间的核间距离是_____cm 。( NA表示阿伏伽德罗常数,用含p、a、b、N的代数式表达)

【答案】 b 分子晶体 氯化铝是分子晶体(共价化合物),熔融状态下不电离 3d84s2 4 ②③ ①③ 平面正方形 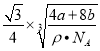
【解析】(1)a. BeCl2分子中Be原子的价层电子对数=2,是直线形结构;b. H2O分子中O原子的价层电子对数=4,含有2对孤对电子,是V形结构;c. HCHO分子中碳原子的价层电子对数=3,是平面形结构;d. CS2分子中C原子的价层电子对数=2,是直线形结构;答案选b;
(2)己知AlCl3的沸点较低,易升华,因此AlCl3的晶体类型为分子晶体;由于氯化铝是分子晶体(共价化合物),熔融状态下不电离,所以工业上一般不采用电解熔融氯化铝的方法制备金属铝。(3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T 比Q 多2,因此只能是第四周期第Ⅷ族,T是Ni,Q是Fe。Ni的原子序数是28,基态原子外围电子(价电子)排布式为3d84s2,Fe2+的核外电子排布为1s22s22p63s33p63d6,所以未成对电子数是4。(4)由于在NaCl晶体中,每个Na+周围同时吸引着最近的等距离的6个Cl-,同样每个Cl-周围同时吸引着最近的等距离的6个Na+,图2中符合条件,图3中选取其中一个离子,然后沿X、Y、Z三轴切割得到6个等距离的且最近的带相反电荷的离子,所以其配位数也是6,故符合条件的是②③;(5)[Cu(NH3)4]2+配离子中存在的化学键类型有配位键、极性共价键,答案选①③。已知:[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3 被两个Cl-取代时,能得到两种不同结构的产物,因此[Cu(NH3)4]2+的空间构型为平面正方形。(6)晶胞中X原子数目为8×1/8+6×1/2=4、Y原子数目为8,晶胞的质量为(4a+8b)/NAg,晶体密度为ρg/cm3,则晶胞体积为为(4a+8b)/NAg÷ρg/cm3,故晶胞棱长x=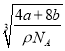 。Y原子与周围4个X原子形成正四面体结构,令Y与X之间的距离为y,则正四面体中心到底面中心的距离为y/3,正四面体的高为4y/3,正四面体棱长=
。Y原子与周围4个X原子形成正四面体结构,令Y与X之间的距离为y,则正四面体中心到底面中心的距离为y/3,正四面体的高为4y/3,正四面体棱长=![]() ,则正四面体侧面的高为
,则正四面体侧面的高为![]() ,底面中心到边的距离为
,底面中心到边的距离为![]() ,故
,故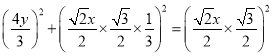 ,整理得y=
,整理得y= ![]() ,故Y与X的距离为
,故Y与X的距离为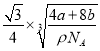 cm。
cm。