题目内容
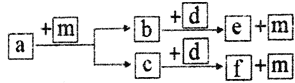
【题目】短周期元素W、X、Y、Z的原子序数依次递增, a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是
A. 简单离子半径:Z>Y
B. Z2Y2中既含有离子键又含有共价键,其中阳离子和阴离子的比值为2∶1
C. 简单气态氢化物的热稳定性:Y>X
D. 由上述4种元素组成的化合物属于离子化合物
【答案】A
【解析】短周期元素W、X、Y、Z的原子序数依次递增, a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,为Na2O2,m为元素Y的单质,为O2,Y为O,有两种常见物质H2O、CO2能与Na2O2反应生成O2,W、X、Y、Z分别为H、C、O、Na四种元素,a、b、c、d、e、f可能为CH4(或其它烃或烃的含氧衍生物)、H2O或CO2、CO2或H2O、Na2O2、NaOH或Na2CO3或NaOH,m为O2。
A、Na+ 小于O2― ,电子层结构相同时,原子核电荷大的半径反而小,故A 错误;B、过氧化钠为离子化合物,离子晶体中既含有钠离子和过氧根离子形成的离子键,也会有O-O共价键,阳离子Na+ 和阴离子O22―的比值为2∶1,故B正确;C 、O―H的键能比C―H的键能大,简单气态氢化物的热稳定性:Y>X,故C正确;D、由上述4种元素组成的化合物NaHCO3属于离子化合物,故D正确。

【题目】元素单质及其化合物有广泛用途,请回答下列问题:
(1)第三周期元素中,钠原子核外有_______种能量不同的电子;氯原子的最外层电子排布式为______________;由这两种元素组成的化合物的电子式为__________。
(2)下列气体能用浓硫酸干燥的是________。
A.NH3 B.HI C.SO2 D.CO2
(3)请用一个实验事实说明钠与镁的金属性强弱________________________________。
(4)KClO3可用于实验室制O2,若不加催化剂,400 ℃时可分解生成两种盐,化学方程式为:KClO3 ![]() KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
(5)已知:
化合物 | MgO | MgCl2 |
类型 | 离子化合物 | 离子化合物 |
熔点/℃ | 2800 | 714 |
工业上电解MgCl2制单质镁,而不电解MgO的原因是________________________________。




