题目内容
【题目】工业上“固定”和利用CO2能有效地减轻“温室效应”。
I.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):

回答下列问题:
(1)该反应在______条件下能自发进行(城编号)。
A.高温 B.低温 C.任何温度
(2)该反应在0 ~8 min内CO2的平均反应速率是_______。
(3)该反应的平街常数K=______________。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线I改变的条件可能是_________。若实线对应条件下平衡常教为K,虚线I对应条件下平衡常数为K1,盛线II对应条件下平衡常数为K2,则K、K1和K2的大小关系是______。
II.己知25℃时,乙酸和碳酸的电离平衡常数如下表:

(1)用饱和氨水吸收CO2可得到NH4HCO3溶液,若已知CH3COONH4溶液pH=7,则NH4HCO3溶液显_____(填“酸性”、“碱性”或“中性”)。
(2)25℃时,在0 . lmol/L乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的
pH=6,那么混合液中 =_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
=_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
【答案】 B 0.125mol/(L·min) 0.5(L/mol)2 升温 K=K2>K1 碱性 18 c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
【解析】I.(1)正反应是体积减小的放热反应,根据△G=△H-T△S<0可知该反应在低温条件下能自发进行,答案选B。(2)根据图像可知该反应在0~8 min内消耗氢气是6mol,根据方程式可知消耗CO2是2mol,浓度是1.0mol/L,是CO2的平均反应速率是1.0mol/L÷8min=0.125mol/(L·min)。(3)平衡时氢气是2mol,生成甲醇和水蒸气均是6mol,所以该反应的平街常数K=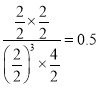 。(4)与实线相比,虚线I到达平衡的时间减少,但氢气平衡时的量增加,说明平衡向逆反应方向,由于正反应是体积减小的放热反应,因此改变的条件可能是升高温度。与实线相比,虚线II到达平衡的时间减少,但氢气平衡时的量减少,说明平衡向正反应方向,因此改变的条件是增大压强。又因为平衡常数只与温度有关系,则K、K1和K2的大小关系是K=K2>K1。II.(1)根据盐类水解规律,已知CH3COONH4溶液pH=7,又因为H2CO3酸性比CH3COOH弱,水解程度更大,所以 NH4HCO3显碱性。 ( 2 )根据pH可知c(H+)=10-6mol/L和醋酸的电离常数Ka=c(CH3COO)c(H+)/c(CH3COOH)=1.8×10-5可知c(CH3COO)/c(CH3COOH)=18;溶液显酸性,则该混合溶液中的离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
。(4)与实线相比,虚线I到达平衡的时间减少,但氢气平衡时的量增加,说明平衡向逆反应方向,由于正反应是体积减小的放热反应,因此改变的条件可能是升高温度。与实线相比,虚线II到达平衡的时间减少,但氢气平衡时的量减少,说明平衡向正反应方向,因此改变的条件是增大压强。又因为平衡常数只与温度有关系,则K、K1和K2的大小关系是K=K2>K1。II.(1)根据盐类水解规律,已知CH3COONH4溶液pH=7,又因为H2CO3酸性比CH3COOH弱,水解程度更大,所以 NH4HCO3显碱性。 ( 2 )根据pH可知c(H+)=10-6mol/L和醋酸的电离常数Ka=c(CH3COO)c(H+)/c(CH3COOH)=1.8×10-5可知c(CH3COO)/c(CH3COOH)=18;溶液显酸性,则该混合溶液中的离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案

