题目内容
13.某元素最高正价氧化物对应的水化物的化学式是HnXOm,该元素的气态氢化物的化学式为( )| A. | HnX | B. | H(2m-n)X | C. | H(8+n-2m) X | D. | H(8+2m-n) X |
分析 元素的最高正价+|最低负价|=8,根据元素的最高价氧化物的水化物的化学式确定最高正价,进而求得最低负价,得出气态氢化物的化学式.
解答 解:元素X的最高价氧化物的水化物的化学式为HnXOm,所以X的最高正价是+(2m-n)价,所以最低负价为-(8+n-2m)价,X的气态氢化物的化学式为H(8+n-2m) X.
故选:C.
点评 本题考查元素在周期表中的位置以及元素的性质,题目难度不大,注意最高化合价与最低化合价之间的关系,二者绝对值之和为8.

练习册系列答案
相关题目
4.下列有关物质结构的说法正确的是( )
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | HBr的电子式为H+(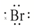 )- )- | |
| C. | 3.4g氨气中含有0.6NA个N-H键 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
1.五种短周期元素D、E、F、X、Y、Z的原子序数依次增大,D、E两元素最高正价与最低负价之和均为0,E元素的一种同位素常用于考古断代,D和X同主族,F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,X和Z形成的二元化合物是厨房常用的调味品.回答下列问题:
①E元素在元素周期表中的位置是第二周期IVA族.
②由D和F,Y,Z所形成的最简单常见共价型化合物中,还原性最强的是PH3(用化学式表示).
③F、X、Z形成的简单离子半径从大到小顺序为Cl->N3->Na+(用离子符号表示).
④X与Z能形成一种离子化合物,用电子式表示其形成过程: .
.
⑤2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是同素异形体.
①E元素在元素周期表中的位置是第二周期IVA族.
②由D和F,Y,Z所形成的最简单常见共价型化合物中,还原性最强的是PH3(用化学式表示).
③F、X、Z形成的简单离子半径从大到小顺序为Cl->N3->Na+(用离子符号表示).
④X与Z能形成一种离子化合物,用电子式表示其形成过程:
 .
.⑤2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是同素异形体.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
8.下列反应不能设计成原电池的是( )
| A. | 2CH3OH+3O2→2CO2+4H2O | B. | NaOH+HCl=NaCl+H2O | ||
| C. | Zn+2HCl=ZnCl2+H2↑ | D. | 4Al+3O2+6H2O=4Al(OH)3 |
5.某温度下,某反应达到平衡,平衡常数k=C(CO2).C(H2)/C(CO).C(H2O).恒容时,升高温度,CO浓度增大.下列说法正确的是( )
| A. | 升高温度,逆反应速率增大,正反应速率减小 | |
| B. | 恒温时,增大压强,CO浓度不变 | |
| C. | 该反应的化学方程式为:CO2+H2?CO+H2O | |
| D. | 该反应的焓变为负值 |
2.下列含有非极性键的共价化合物是( )
| A. | H2 | B. | Na2O2 | C. | H2O2 | D. | CH4 |
3.电解降解法可用于治理水体硝酸盐污染,将NO3-降解成N2的电解装置如图所示.下列说法正确的是( 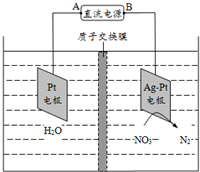

| A. | 电源的正极为b | |
| B. | 电解时H+从膜右侧迁移到膜左侧 | |
| C. | Ag-Pt电极反应为:2H2O-4e-=4H++O2↑ | |
| D. | 若转移的电子数为1.204×1024,生成N25.6 g |
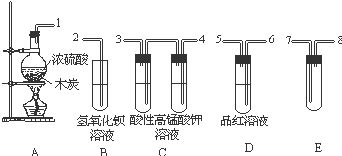 浓H2SO4与炭反应,产物成分可用如图装置来确认:
浓H2SO4与炭反应,产物成分可用如图装置来确认: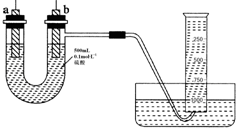 现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.
现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.