题目内容
8.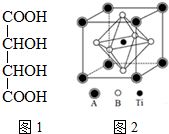 钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途.
钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途.(1)写出Se的基态原子的外围电子排布式4s24p4.
(2)酒石酸钛配合物广泛应用于药物合成.酒石酸(结构如图1所示)中羧基氧原子的轨道杂化类型分别是sp2、sp3,1mol酒石酸中π键的数目是2NA.
(3)TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于分子晶体晶体;NO3-离子的空间构型为平面三角形.
(4)主族元素A和钛同周期,具有相同的最外层电子数,元素B原子的p能级所含电子总数与s能级所含电子总数相等,且其形成的氢化物分子之间存在氢键.元素A、元素B和钛三者形成的晶体的晶胞如图2所示,写出该晶体的化学式CaTiO3(用元素符号表示).
分析 (1)Se的原子核外有34个电子,最外层有6个电子;
(2)羧基氧原子的价层电子对数判断;双键中含有一个π键;
(3)分子晶体的熔沸点较低;NO3-的价层电子对数=成键电子对数+孤电子对数,然后判断杂化类型和空间构型;
(4)主族元素A和钛同周期,具有相同的最外层电子数,则最外层含有2个电子,A为Ca元素,元素B原子的p能级所含电子总数与s能级所含电子总数相等,且其形成的氢化物分子之间存在氢键,已知N、O、F的氢化物能形成氢键,则B为O,Ca占据晶胞的顶点,O占据面心,Ti在晶胞内部,根据均摊法计算.
解答 解:(1)Se的原子核外有34个电子,最外层有6个电子,则其核外电子分4层排布,最外层为电子排布为4s24p4,故答案为:4s24p4;
(2)羧基的结构式为-$\stackrel{\stackrel{O}{∥}}{C}$-O-H,两个O原子的价层电子对数分别为3、4,则杂化类型分别为sp2、sp3;酒石酸分子中含有2个羧基,每个羧基含有一个C=O,双键中含有一个π键,则一分子酒石酸中含有2个π键,所以1mol酒石酸中π键的数目是2NA;
故答案为:sp2、sp3;2NA;
(3)已知TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,分子晶体的熔沸点较低,则TiCl4属于分子晶体;NO3-中N原子的价层电子对数=3+$\frac{1}{2}$(5+1-3×2)=3,属于sp2杂化,没有孤电子对,所以离子的构型为平面三角形;
故答案为:分子晶体;平面三角形;
(4)主族元素A和钛同周期,具有相同的最外层电子数,则最外层含有2个电子,A为Ca元素,元素B原子的p能级所含电子总数与s能级所含电子总数相等,且其形成的氢化物分子之间存在氢键,已知N、O、F的氢化物能形成氢键,则B为O,Ca占据晶胞的顶点,则晶胞中Ca的个数为$\frac{1}{8}$×8=1,O占据面心,则晶胞中O原子的个数为$\frac{1}{2}$×6=3,Ti在晶胞内部,完全属于该晶胞,则该晶体的化学式CaTiO3,故答案为:CaTiO3.
点评 本题考查了物质结构与性质,主要涉及了电子排布式、杂化类型的判断、分子构型的判断、晶胞的计算等,题目难度中等,侧重于对基础知识的综合应用的考查.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案| A. | 充电时电源的正极应与电池的X极相连 | |
| B. | 放电时负极电极反应式为:XH6+6e-═X+6H+ | |
| C. | 充电时阳极电极反应式为:6Ni(OH)2+6OH-═6NiOOH+6H2O+6e- | |
| D. | 该电池放电反应1 mol XH6时,若用于电解水,理论上可得到16g氧气 |
| A. | 在周期表中,氯元素位于硫元素之后,所以Cl2的氧化性弱于硫单质 | |
| B. | 硫黄中只有非极性键,S2Cl2中只有极性键 | |
| C. | 在常温常压下,硫黄是原子晶体,S2Cl2是分子晶体 | |
| D. | S2Cl2与水反应时,既体现氧化性又体现还原性 |
| A. | 该反应中电子转移数为6 | B. | 生成的氯气式量约为73.3 | ||
| C. | KCl中既有35Cl,又有37Cl | D. | KCl中只含35Cl |
| A. | 金属钠在空气中燃烧的火焰呈黄色,是因为生成的Na2O2为淡黄色固体 | |
| B. | 铁丝在Cl2中燃烧有红棕色的烟,是因为生成的FeCl3为红棕色固体 | |
| C. | 过量的铁加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色,说明稀HNO3将Fe氧化为Fe3+ | |
| D. | 取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| A. | 84% | B. | 60% | C. | 91% | D. | 无法计算 |
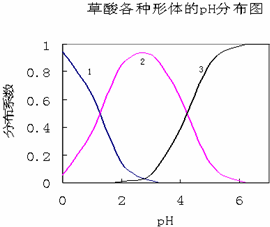 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示: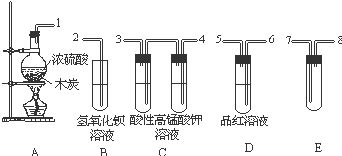 浓H2SO4与炭反应,产物成分可用如图装置来确认:
浓H2SO4与炭反应,产物成分可用如图装置来确认: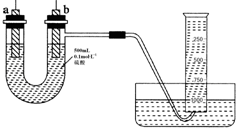 现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.
现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.