��Ŀ����
�����13�֣��ס�����ͬѧ�о�Na2SO3��Һ��FeCl3��Һ��Ӧ�������
��1�������£�FeCl3��Һ��pH_______7�����������������������
��2���������ɫ������ԭ��
�� ��ͬѧ��Ϊ����I����Һ�ʺ��ɫ����Ϊ������Fe(OH)3�����û�ѧƽ���ƶ�ԭ��������Һ�ʺ��ɫ��ԭ��________��
�� ��ͬѧ��Ϊ�����Ƿ�����������ԭ��Ӧ������Fe3+ ��Fe2+ ����д��Fe3+ ��SO32����Ӧ�����ӷ���ʽ
______________��
��ͬѧ�������ϵ�֪��
1��Fe2+��SO32����Ӧ����ī��ɫ����״����FeSO3��
2��ī��ɫ��FeSO3���ɫ��FeCl3��Һ��Ϻ���Һ�ʺ��ɫ��
��3����ͬѧΪ��ȷ����Һ�ʺ��ɫ��ԭ����������Fe(OH)3����Ʋ����������ʵ�飺
��ͬѧ��˵ó����ۣ���Һ�ʺ��ɫ����Ϊ������Fe(OH)3������ͬѧ��Ϊ��ͬѧ�ó����۵�֤����Ȼ���㣬��ͬѧ��������________��
��4��Ϊ��һ��ȷ��Na2SO3��Һ��FeCl3��Һ��Ӧ���������ͬѧ��Ʋ����������ʵ�飺
�� �����鲽����к��ɫ��Һ����Fe2+������Fe2+ѡ�õ��Լ���_________������ĸ����
a��K3[Fe(CN)6] ��Һ b��KSCN��Һ c��KMnO4��Һ
�� �������ӷ���ʽ�ͱ�Ҫ������˵��������г��ֺ��ɫ��ԭ�� ��
��5�����ۣ�������ʵ���֪���ס�����ͬѧ���ֹ۵����ȷ��
| ���� | ���� | ���� |
| �� | ��2mL 1 mol��L-1FeCl3��Һ�м���һ������Na2SO3��Һ | ��Һ���ػ�ɫ��Ϊ���ɫ�����������̼�����ζ�������ݳ� |
��2���������ɫ������ԭ��
�� ��ͬѧ��Ϊ����I����Һ�ʺ��ɫ����Ϊ������Fe(OH)3�����û�ѧƽ���ƶ�ԭ��������Һ�ʺ��ɫ��ԭ��________��
�� ��ͬѧ��Ϊ�����Ƿ�����������ԭ��Ӧ������Fe3+ ��Fe2+ ����д��Fe3+ ��SO32����Ӧ�����ӷ���ʽ
______________��
��ͬѧ�������ϵ�֪��
1��Fe2+��SO32����Ӧ����ī��ɫ����״����FeSO3��
2��ī��ɫ��FeSO3���ɫ��FeCl3��Һ��Ϻ���Һ�ʺ��ɫ��
��3����ͬѧΪ��ȷ����Һ�ʺ��ɫ��ԭ����������Fe(OH)3����Ʋ����������ʵ�飺
| ���� | ���� | ���� |
| �� | �ü�������䲽��I�еĺ��ɫ��Һ | ���֡������ЧӦ�� |
��4��Ϊ��һ��ȷ��Na2SO3��Һ��FeCl3��Һ��Ӧ���������ͬѧ��Ʋ����������ʵ�飺
| ���� | ���� | ���� |
| �� | ��1 mol?L-1��FeCl3��Һ��ͨ��һ������SO2 | ��Һ�ɻ�ɫ��Ϊ���ɫ |
| �� | �ü�������䲽����еĺ��ɫ��Һ | û�г��֡������ЧӦ�� |
a��K3[Fe(CN)6] ��Һ b��KSCN��Һ c��KMnO4��Һ
�� �������ӷ���ʽ�ͱ�Ҫ������˵��������г��ֺ��ɫ��ԭ�� ��
��5�����ۣ�������ʵ���֪���ס�����ͬѧ���ֹ۵����ȷ��
��1������1�֣� ��2�� �� Fe3++3H2O Fe(OH)3+3H+������Na2SO3��c(H+)�½���ƽ�������ƶ�������Fe(OH)3�����ӷ���ʽ1�֣�ƽ���ƶ�����1�֣���2�֣�
Fe(OH)3+3H+������Na2SO3��c(H+)�½���ƽ�������ƶ�������Fe(OH)3�����ӷ���ʽ1�֣�ƽ���ƶ�����1�֣���2�֣�
�� 2Fe3+ + SO32- +H2O ==2Fe2+ +SO42-+2H+ ��2�֣�
��3��FeSO3��FeCl3�Ļ����ҺҲ���ܳ��֡������ЧӦ�� ��2�֣���4���� a ��1�֣�
�� 2Fe3+ + SO2 + 2H2O �� 2Fe2+ + SO2- 4 + 4H+�� Fe2+ + SO2 +H2O �� FeSO3�� + 2H+����2Fe3+ + 3SO2 + 4H2O ��2FeSO3��+ SO2- 4 + 8H+����FeSO3��ʣ���FeCl3��Һ��϶����ֺ��ɫ����ÿ������ʽ2�֣����ֲ���1�֣���5�֣�
 Fe(OH)3+3H+������Na2SO3��c(H+)�½���ƽ�������ƶ�������Fe(OH)3�����ӷ���ʽ1�֣�ƽ���ƶ�����1�֣���2�֣�
Fe(OH)3+3H+������Na2SO3��c(H+)�½���ƽ�������ƶ�������Fe(OH)3�����ӷ���ʽ1�֣�ƽ���ƶ�����1�֣���2�֣��� 2Fe3+ + SO32- +H2O ==2Fe2+ +SO42-+2H+ ��2�֣�
��3��FeSO3��FeCl3�Ļ����ҺҲ���ܳ��֡������ЧӦ�� ��2�֣���4���� a ��1�֣�
�� 2Fe3+ + SO2 + 2H2O �� 2Fe2+ + SO2- 4 + 4H+�� Fe2+ + SO2 +H2O �� FeSO3�� + 2H+����2Fe3+ + 3SO2 + 4H2O ��2FeSO3��+ SO2- 4 + 8H+����FeSO3��ʣ���FeCl3��Һ��϶����ֺ��ɫ����ÿ������ʽ2�֣����ֲ���1�֣���5�֣�
�����������1���Ȼ�����ǿ�������Σ�������ˮ����Һ�����ԣ���˳����£�FeCl3��Һ��pH��7��
��2���� ���Ȼ�����Һ�д��������ӵ�ˮ��ƽ�⣺Fe3++3H2O
 Fe(OH)3+3H+������Na2SO3�����������ӣ���Һ��c(H+)�½���ƽ�������ƶ�������Fe(OH)3��
Fe(OH)3+3H+������Na2SO3�����������ӣ���Һ��c(H+)�½���ƽ�������ƶ�������Fe(OH)3���������Ӿ��������ԣ��������ƾ��л�ԭ�ԣ����߿��Է���������ԭ��Ӧ�����ӷ���ʽΪ2Fe3+ + SO32- +H2O==2Fe2+ +SO42-+2H+��
��3������FeSO3��FeCl3��Ϻ�ʹ����Ӧ�������ҺҲ���ܳ��֡������ЧӦ����
��4����������Һ�Ժ��ɫ����Ȼ��������������������Һ��Ӧ�����������ԣ����Լ����������ӵ��Լ�Ӧ��ѡ��K3[Fe(CN)6] ��Һ��ʵ����������Һ�в�����ɫ��������ѡa��
������Һ����������SO2����������ԭ��Ӧ��2Fe3+ + SO2 + 2H2O ��2Fe2+ + SO2- 4 + 4H+�����ɵ�����������SO2������Ӧ��Fe2+ + SO2 +H2O��FeSO3�� + 2H+����2Fe3+ + 3SO2 + 4H2O ��2FeSO3��+ SO2- 4 + 8H+�������ɵ�FeSO3��ʣ���FeCl3��Һ��϶����ֺ��ɫ��

��ϰ��ϵ�д�
�����Ŀ
 ԭ�������������������ȼ��̶�װ��ʡ�ԣ��Ʊ����������CO������CO��ԭCuO��ĩ��
ԭ�������������������ȼ��̶�װ��ʡ�ԣ��Ʊ����������CO������CO��ԭCuO��ĩ��
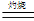 2 Cu2O + O2������ Cu2O +2H+
2 Cu2O + O2������ Cu2O +2H+
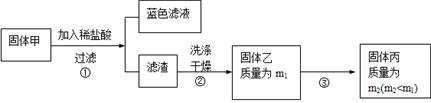 ��3�� �������ڿ���������ʱ��ʹ�õ�ʵ���������˲����������żܡ��ƾ����⣬�������У� ��
��3�� �������ڿ���������ʱ��ʹ�õ�ʵ���������˲����������żܡ��ƾ����⣬�������У� ��