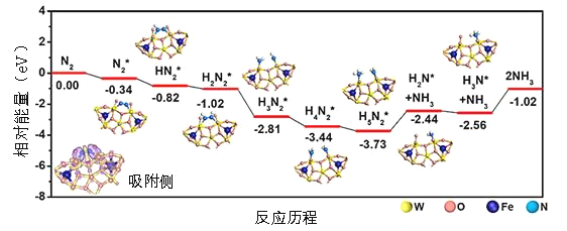
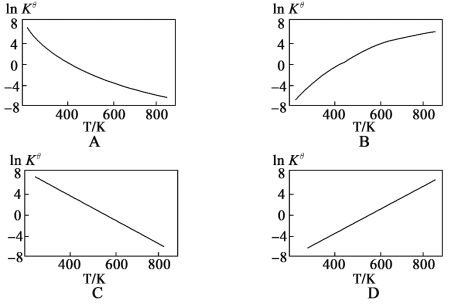
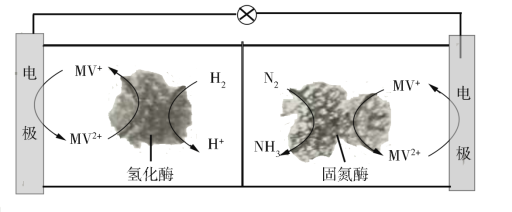
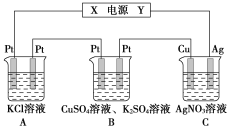
题目内容
【题目】硫酸是当今世界上最重要的化工产品之一,广泛应用于工业各个方面。硫酸的生产工艺几经改进,目前工业上主要采用接触法制备硫酸。接触室中发生如下反应:2SO2+O2![]() 2SO3。
2SO3。
(1)上述生成SO3的反应属于__________
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
(2)该反应是氧化还原反应,下列说法正确的是__________
A.SO2是氧化剂
B.O2发生氧化反应
C.O2失去电子
D.SO3既是氧化产物又是还原产物
(3)该反应也是放热反应,下列说法不正确的是__________
A.形成SO3中的硫氧键放出能量
B.断开SO2中的硫氧键放出能量
C.反应物的总能量大于生成物的总能量
D.放热反应的逆反应一定是吸热反应
(4)下列关于该反应的说法中,正确的是__________
A.增大接触室内炉气的压强对化学反应速率无影响
B.升高温度能加快反应速率
C.添加催化剂对反应速率无影响
D.增大O2的浓度能使SO2完全转化
【答案】A D B B
【解析】
(1) 2SO2+O2![]() 2SO3,生成SO3的反应属于化合反应,故A符合题意。
2SO3,生成SO3的反应属于化合反应,故A符合题意。
综上所述,答案为A。
(2)A. SO2中S化合价升高,是还原剂,故A错误;
B. O2化合价降低,发生还原反应,故B错误;
C. O2化合价降低,得到电子,故C错误;
D. SO3既是升高得到的产物,又是降低得到的产物,因此既是氧化产物又是还原产物,故D正确。
综上所述,答案为D。
(3)A. 形成SO3中的硫氧键放出能量,故A正确;
B. 断开SO2中的硫氧键吸收能量,故B错误;
C. 放热反应是反应物的总能量大于生成物的总能量,故C正确;
D. 放热反应的逆反应一定是吸热反应,故D正确。
综上所述,答案为B。
(4)A. 增大接触室内炉气的压强,加快化学反应速率,故A错误;
B. 升高温度,增加了分子的能量,活化分子数目增多,碰撞几率增加,因此能加快反应速率,故B正确;
C. 添加催化剂加快反应速率,故C错误;
D. 增大O2的浓度,不可能使SO2完全转化,可逆反应转化率不能100%,故D错误。
综上所述,答案为B。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案