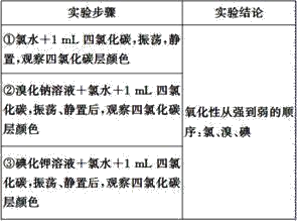
题目内容
【题目】部分被氧化的铝箔5.01 g,加入足量的10%的稀盐酸,充分反应后收集到0.5 g氢气。
(1)被氧化的金属铝的质量为多少克?__________________
(2)参加反应的稀盐酸的质量为多少克?____________________
【答案】被氧化的金属铝的质量为0.27 g 参加反应的稀盐酸的质量为193.45 g
【解析】
(1)根据生成的氢气的质量结合反应方程式计算参与反应的铝的质量,再计算被氧化的金属铝的质量;
(2)参加反应的稀盐酸的总量等于与铝反应的盐酸和与氧化铝反应的盐酸的物质的量之和,再根据浓度(质量分数)计算参加反应的稀盐酸的质量。
(1)设与盐酸反应的Al的质量为x,与铝反应的HCl的物质的量为y,
2Al + 6HCl=2AlCl3+ 3H2↑
54g 6mol 6g
x y 0.5g
![]() =
=![]() =
=![]() 解得:x=4.5 g,y=0.5 mol,m(Al2O3)=5.01g-4.5g=0.51 g,n(Al2O3)=
解得:x=4.5 g,y=0.5 mol,m(Al2O3)=5.01g-4.5g=0.51 g,n(Al2O3)=![]() =0.005 mol,被氧化n(Al)=0.005 mol×2= 0.01 mol,即被氧化的Al的质量为0.01 mol ×27g/mol=0.27 g,故答案为:0.27 g;
=0.005 mol,被氧化n(Al)=0.005 mol×2= 0.01 mol,即被氧化的Al的质量为0.01 mol ×27g/mol=0.27 g,故答案为:0.27 g;
(2)Al2O3 + 6HCl=2AlCl3+ 3H2O
0.005mol 0.03mol
参加反应的HCl总量=0.5 mol+0.03 mol=0.53 mol,m(HCl)=0.53 mol ×36.5g/mol=19.345g,需要10%的稀盐酸![]() =193.45g,故答案为:193.45g。
=193.45g,故答案为:193.45g。

练习册系列答案
相关题目